
【题目】已知:H2(g)+F2(g)=2HF(g)的能量变化如图所示,有关叙述中不正确的是( )
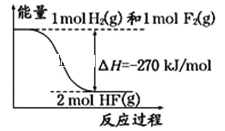
A. 氟化氢气体分解生成氢气和氟气的反应是吸热反应
B. 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C. 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D. 断裂1 mol H﹣H键和1 mol F﹣F 键吸收的能量小于形成2 mol H﹣F键放出的能量
【答案】B
【解析】
通过图像可知,反应物的总能量大于生成物的总能量,为放热反应,且H2(g)+F2(g)=2HF(g) ![]() H=-270kJ/mol;
H=-270kJ/mol;
A. 氟化氢气体分解生成氢气和氟气的反应是H2(g)+F2(g)=2HF(g)的逆过程,则氟化氢分解为吸热反应,A正确;
B.HF(g)转化为 HF(l)放热,1 mol H2与1 mol F2反应生成2 mol液态HF放出的能量大于270 kJ,B错误;
C. 通过图像可知,反应物的总能量大于生成物的总能量,C正确;
D.化学反应在旧键的断裂吸收能量,新键的形成放出能量,此反应为放热反应,则断裂1 mol H﹣H键和1 mol F﹣F 键吸收的能量小于形成2 mol H﹣F键放出的能量,D正确;
答案为B


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案科目:高中化学 来源: 题型:
【题目】按要求回答以下问题:
Ⅰ.认真观察下列装置,回答下列问题:

(1)装置B中PbO2上发生的电极反应方程式为________。连接装置B、C的U形管中装填含有琼脂的KCl饱和溶液,其作用是______。
(2)装置A中总反应的离子方程式为___________________。
(3)若装置E的目的是在Cu材料上镀银,则X为_____,极板N的材料为_____。
(4)装置D中NaCl溶液的pH会__________。(填“增大”“减小”“不变”)
Ⅱ.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为____________。
Ⅲ.二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺。
(1)图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为____________。
(2)电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量___mol;请用方程式解释阴极区pH增大的原因:___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1价和+2价的化合物。
(1)写出基态Cu+的核外电子排布式___________________________________。
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为________。

(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过________键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是____。与NH3分子互为等电子体的一种微粒是________。
(4)CuO的熔点比CuCl的熔点____(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题
(1)常温下,H2SO3的电离常数Ka1=1.0×10-2、Ka2=1.0×10-7。NaHSO3的水解平衡常数Kh=________,其溶液pH________(填“>”“<”或“=”)7;若向NaHSO3溶液中加入少量的I2(I2能氧化+4价的硫),则溶液中c(H2SO3)/c(HSO3-)将________(填“增大”“减小”或“不变”)。
(2)已知25 ℃时,Ksp[Mg(OH)2]=1.8×10-11。25 ℃时,向0.01 mol·L-1的MgCl2溶液中逐滴加入浓NaOH溶液,刚好出现沉淀时,溶液的c(H+)为________;当Mg2+完全沉淀时,溶液的pH为________。(忽略溶液体积变化,已知![]()
![]() ,lg 7.7=0.9)
,lg 7.7=0.9)
(3)量取10.00 mL密度为1.13 g·mL-1的H2O2溶液至烧杯中稀释,冷却后转移至250 mL容量瓶中,加水定容,摇匀。移取配制好的过氧化氢溶液25.00 mL至锥形瓶中,加入稀H2SO4酸化,用蒸馏水稀释,作被测试样。用KMnO4标准溶液滴定被测试样,重复滴定三次,平均耗用1 mol·L-1KMnO4标准溶液11.30 mL,则
①滴定到达终点的现象___________________________________________
②原H2O2溶液中H2O2的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为 _________ mol/L;
(2)某学生欲用上述浓盐酸和蒸馏水配制480mL 物质的量浓度为0.400mol/L的稀盐酸,
①该学生需要量取__________ mL上述浓盐酸进行配制;
②所需玻璃仪器有:玻璃棒、烧杯、量筒、__________ 、__________ ;
③在配制过程中,下列实验操作会导致所配制的稀盐酸的物质的量浓度偏高的有__________ 。
A.定容时,俯视容量瓶刻度线进行定容;
B.在烧杯中将浓盐酸进行稀释后立即转入容量瓶;
C.转移溶液时,不慎有少量溶液洒到容量瓶外面;
D.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水;
E.定容摇匀后,发现液面低于刻度线,再加蒸馏水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2装入带有活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入稀有气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.5mol N2O4气体通入体积为5L的恒容密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02 mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s)
B. 在2秒时体系内的压强为开始时的1.2倍
C. 在平衡时体系内含N2O40.20mol
D. 平衡时,如果再充入一定量N2O4, 则可提高N2O4的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析化学、医药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是_______(用必要的化学用语和相关文字说明).
(2)相同条件下,0.1mol·L-1的NH4Al(SO4)2溶液中c((NH4+)________(填“等于”、“大于”或“小于”)0.1mol·L-1 NH4HSO4中c((NH4+).
(3)均为0.1mol·L-1的几种电解质溶液的pH随温度变化的曲线如图1所示.

①其中符合0.1mol·L-1 NH4Al(SO4)2的pH随温度变化的曲线是__,导致pH随温度变化的原因是___________________;
②20℃时,0.1mol·L-1的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______.
(4)室温时,向100mL0.1mol·L-1的NH4HSO4溶液中滴加0.1mol·L-1的NaOH溶液,溶液pH与所加NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是________点;在b点,溶液中各离子浓度由大到小的排列顺序是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 向盐酸中加入氨水至中性,溶液中![]()
B. 在蒸馏水中滴加浓H2SO4,Kw不变
C. 向0.1 mol/L CH3COOH溶液中加入少量水,溶液中![]() 增大
增大
D. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com