
【题目】纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1价和+2价的化合物。
(1)写出基态Cu+的核外电子排布式___________________________________。
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为________。

(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过________键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是____。与NH3分子互为等电子体的一种微粒是________。
(4)CuO的熔点比CuCl的熔点____(填“高”或“低”)。
【答案】 1s22s22p63s23p63d10或[Ar]3d10 CuO 配位 sp3 H3O+或PH3等 高
【解析】(1)Cu原子核外电子数为29,根据能量最低原理,其核外电子排布式为:1s22s22p63s23p63d104s1,则基态Cu+的核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10;(2)由晶胞示意图可知,1个晶胞中有4个铜,氧为8×![]() +6×
+6×![]() =4个,原子个数之比为1:1,该氧化物的化学式为CuO;(3)NH3中N原子提供孤对电子,Cu2+提供空轨道,形成配位键,NH3分子中N原子的价电子对数 n=
=4个,原子个数之比为1:1,该氧化物的化学式为CuO;(3)NH3中N原子提供孤对电子,Cu2+提供空轨道,形成配位键,NH3分子中N原子的价电子对数 n=![]() ,N原子为 sp3 杂化;与NH3分子互为等电子体的一种微粒具有相同的价电子数和原子数,如PH3或H3O+等;(4)离子化合物中,离子半径越小,离子键越强,熔点越高,离子半径O2-<Cl-,CuO阴阳离子所带电荷大于CuCl阴阳离子所带电荷,CuO中晶格能大,则CuO的熔点比CuCl的熔点高。
,N原子为 sp3 杂化;与NH3分子互为等电子体的一种微粒具有相同的价电子数和原子数,如PH3或H3O+等;(4)离子化合物中,离子半径越小,离子键越强,熔点越高,离子半径O2-<Cl-,CuO阴阳离子所带电荷大于CuCl阴阳离子所带电荷,CuO中晶格能大,则CuO的熔点比CuCl的熔点高。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
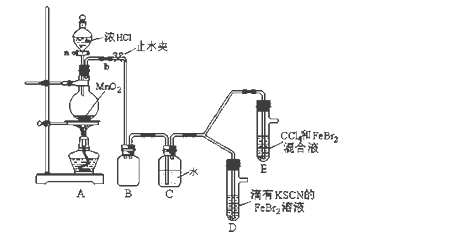
(1)①装置A中发生反应的离子方程式是_____________________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3 是一个可逆反应。
Fe(SCN)3 是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________溶液,若溶液颜色________,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释产生白色沉淀原因__________________、_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的 物质的量浓度的负对数与溶液的pH的变化悄况如图所示。

下列说法正确的是( )
A. 曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B. ![]()
C. 溶液中水的电离程度:M>N
D. N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H是一种重要的高分子化合物,其合成路线如下:
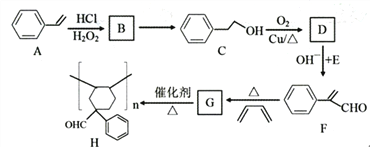
已知:
请回答下列问题:
(1)A的名称是_______________,C中含氧官能团名称是______________。
(2)写出反应类型:A→B______________,C→D__________________。
(3)B→C的反应试剂和反应条件是______________________。
(4)D+E→F的反应方程式是_________________。
(5)G的分子式是____________________。
(6)满足下列条件的F的同分异构体共有__________种(不考虑立体异构)。
a.苯环上有两个取代基,无其他环状结构;b.含碳碳三键,无-C≡COH结构。
(7)多环化合物是有机研究的重要方向,请设计由![]() 、.CH3CHO、
、.CH3CHO、![]() -CHO合成多环化合物
-CHO合成多环化合物 的路线(无机试剂任选)______________
的路线(无机试剂任选)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某化学反应过程中,生成物的量与时间的关系,图中a、b、c三条曲线不能反映下列哪种因素对生成物的量的影响( )

A. 不同的温度 B. 不同的pH值
C. 不同的底物浓度 D. 不同的酶浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醛分子的模型,根据该图和所学化学知识回答下列问题:
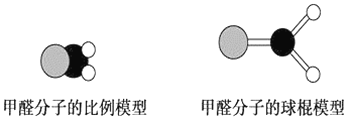
(1)甲醛分子中碳原子的杂化方式是__________,作出该判断的主要理由是__________________________。
(2)下列是对甲醛分子中碳氧键的判断,其中正确的是________(填序号)。
①单键 ②双键 ③σ键 ④π键 ⑤σ键和π键
(3)甲醛分子中C—H键与C—H键间的夹角________(填“=”、“>”或“<”)120°,出现该现象的主要原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为____________;Al与NaOH溶液反应的离子方程式为____________。
(2)30Si的原子的中子数为________________________。SiO2的晶体类型为_____________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是___________________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是____________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废镍催化剂中主要有Ni,还有Al、Fe、SiO2及其它不溶于酸、碱的杂质。现用废镍催化剂制备NiSO4·7H2O晶体,其流程如下图:

已知:Ksp[Fe(OH)3]=8.0×10-38,Ka sp[Fe(OH)2]=8.0×10-16,K[Al(OH)3]=3.2×10-34,Ksp[Ni(OH)2]=2.0×10-15,1g2=0.3,
回答下列问题
(1)“碱浸”的目的是______。
(2)“酸浸时发生的离子方程式为Fe+2H+=Fe2++H2↑、_______。
(3)“净化除杂需要先加入H2O2溶液,发生反应的离子方程式为______,然后调节PH=_______时,使杂质离子恰好完全沉淀(注:离子浓度小于或等于1×10-5mol/L时沉淀完全)
(4)“操作A为”______。
(5)Ni2+在强碱性溶液中还可被NaClO氧化为NiOOH,该反应离子方程式为______。
(6) NiOOH也可作为原电池的电极材料,若在碱性条件下形成燃料电池,负极通入N2H4气体,则负极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(11分)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为________,该元素的符号是________。
(2)Y元素原子的价层电子的电子排布图为________,该元素的名称是________。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________。
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___________________________________________________________。
(5)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由
_________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com