
����Ŀ��ij��ѧ��ȤС��Ϊ̽��Cl2��Br2��Fe3+��������ǿ�������������ʵ�飺
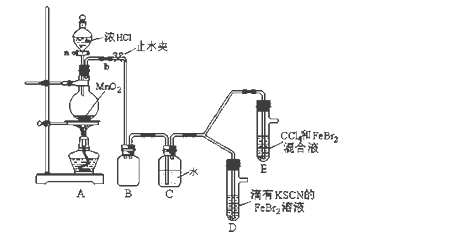
(1)��װ��A�з�����Ӧ�����ӷ���ʽ��_____________________��
������ʵ��װ�ô���һ�����ԵIJ��㣬��ָ��_______________________��
(2)�ø������װ�ý���ʵ�飬ʵ��������£�
ʵ����� | ʵ������ | ���� |
����a����Բ����ƿ�е�������Ũ���Ȼ��رջ���a����ȼ�ƾ��ơ� | Dװ���У���Һ��� Eװ���У�ˮ����Һ��ƣ� ���²�CCl4�������Ա仯�� | Cl2��Br2��Fe3+����������ǿ������˳��Ϊ�� ________________________ |
(3)��æ�ڹ۲�ͼ�¼��û�м�ʱֹͣ��Ӧ��D��E�о��������µı仯��
Dװ���У���ɫ������ȥ��
Eװ���У�CCl4��������ɫ��Ϊ��ɫ������ɫ���ֱ����ɺ�ɫ��
Ϊ̽������ʵ������ı��ʣ�С��ͬѧ����������£�
����Fe3+ +3SCN��![]() Fe(SCN)3 ��һ�����淴Ӧ��
Fe(SCN)3 ��һ�����淴Ӧ��
����(SCN)2������±�ص������ơ������ԣ�Cl2 �� (SCN)2 ��
����Cl2��Br2��Ӧ����BrCl��BrCl�ʺ�ɫ(�Դ���ɫ)���е�Լ5�棬����ˮ�ܷ���ˮ�ⷴӦ���Ҹ÷�ӦΪ��������ԭ��Ӧ��
����AgClO��AgBrO��������ˮ��
������ƽ���ƶ�ԭ��(�����������)����Cl2����ʱD����Һ��ɫ��ȥ��ԭ��___________________________________________������Ƽ�ʵ��֤���������ͣ�ȡ������ɫ�����Һ���μ�______________��Һ������Һ��ɫ________�������������Ǻ����ġ�
����̽��E����ɫ�仯��ԭ�����ʵ�����£�
�÷�Һ©�������E���²���Һ�������ռ���ɫ���ʣ�ȡ����������AgNO3��Һ������۲쵽���а�ɫ��������������������������������ʽ(���ӻ�ѧ����ʽ����)���Ͳ�����ɫ����ԭ��__________________��_______________________
���𰸡�MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O ȱ��β������װ�� Cl2 �� Br2 �� Fe3+ ����������SCN �C��Ӧ2SCN��+Cl2��2Cl��+(SCN)2��ʹSCN��Ũ�ȼ�С����
Mn2++Cl2��+2H2O ȱ��β������װ�� Cl2 �� Br2 �� Fe3+ ����������SCN �C��Ӧ2SCN��+Cl2��2Cl��+(SCN)2��ʹSCN��Ũ�ȼ�С����
Fe3++3SCN��![]() Fe(SCN)3 ƽ�������ƶ�����ɫ�� KSCN��Һ ���ɫ����FeCl3��Һ������죩 BrCl + H2O �� HBrO + HCl Ag++Cl��=AgCl��
Fe(SCN)3 ƽ�������ƶ�����ɫ�� KSCN��Һ ���ɫ����FeCl3��Һ������죩 BrCl + H2O �� HBrO + HCl Ag++Cl��=AgCl��
��������
��1������װ��A��Ũ������MnO2�ڼ���ʱ������Ӧ����������������Ӧ�����ӷ���ʽ��MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O�����������ж����壬����ɴ�����Ⱦ��������ʵ��װ�ô���һ�����ԵIJ��㣬����ȱ��β������װ�á�
Mn2++Cl2��+2H2O�����������ж����壬����ɴ�����Ⱦ��������ʵ��װ�ô���һ�����ԵIJ��㣬����ȱ��β������װ�á�
��2���ø������װ�ý���ʵ�飬ʵ��������£�����a����Բ����ƿ�е�������Ũ���Ȼ��رջ���a����ȼ�ƾ��ƣ��ᷢ�֣�Dװ���У���Һ��죬˵��������Ӧ��Cl2+2Fe2+=2Cl-+2Fe3+��֤�������ԣ�Cl2>Fe3+��Fe3+��SCN-��Һ��Ϊ��ɫ��Eװ���У�ˮ����Һ��ƣ� ���²�CCl4�������Ա仯��֤��������Ӧ��Cl2+2Br-=2Cl-+Br2�������ԣ�Cl2>Br2��Br2+2Fe2+=2Br-+2Fe3+��֤�������ԣ�Br2>Fe3+���Ӷ�֤�������ԣ�Cl2��Br2��Fe3+��
��3��Fe3++3SCN��![]() Fe(SCN)3��һ�����淴Ӧ����Cl2����ʱ��������������SCN �C��Ӧ2SCN��+Cl2��2Cl��+(SCN)2��ʹSCN��Ũ�ȼ�С����Fe3++3SCN��
Fe(SCN)3��һ�����淴Ӧ����Cl2����ʱ��������������SCN �C��Ӧ2SCN��+Cl2��2Cl��+(SCN)2��ʹSCN��Ũ�ȼ�С����Fe3++3SCN��![]() Fe(SCN)3 ƽ�������ƶ�����ɫ������Ƽ�ʵ��֤���������ͣ�ȡ������ɫ�����Һ���μ�KSCN��Һ����Һ������Һ��ɫ���ɫ����֤����ƽ�ⷢ�����ƶ���������Һ�еμ�FeCl3��Һ����Һ�����ɫ��Ҳ֤����Һ��SCN��Ũ�ȼ�С��ƽ�ⷢ�����ƶ���̽��E����ɫ�仯��ԭ���÷�Һ©�������E���²���Һ�������ռ���ɫ���ʣ�ȡ����������AgNO3��Һ������۲쵽���а�ɫ������������������Cl2+Br2=2BrCl��BrCl + H2O ��HBrO + HCl ��Ag++Cl��=AgCl����������Һ��ɫ��ɺ�ɫ��
Fe(SCN)3 ƽ�������ƶ�����ɫ������Ƽ�ʵ��֤���������ͣ�ȡ������ɫ�����Һ���μ�KSCN��Һ����Һ������Һ��ɫ���ɫ����֤����ƽ�ⷢ�����ƶ���������Һ�еμ�FeCl3��Һ����Һ�����ɫ��Ҳ֤����Һ��SCN��Ũ�ȼ�С��ƽ�ⷢ�����ƶ���̽��E����ɫ�仯��ԭ���÷�Һ©�������E���²���Һ�������ռ���ɫ���ʣ�ȡ����������AgNO3��Һ������۲쵽���а�ɫ������������������Cl2+Br2=2BrCl��BrCl + H2O ��HBrO + HCl ��Ag++Cl��=AgCl����������Һ��ɫ��ɺ�ɫ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������м������ʣ��뽫����������пո��ڣ�
A��C60��ʯī B��35Cl��37Cl C��![]() ��
��![]()
D���Ҵ����� E��CH2=CH-COOH�����ᣨC17H33COOH��
�ٻ�Ϊͬλ�ص���______________�� �ڻ�Ϊͬϵ�����_________________��
�ۻ�Ϊͬ�����������__________�� �ܻ�Ϊͬ���칹�����_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.10mol��L��1KOH��Һ�ζ�10.00mL0.10mol��L��1H2C2O4(��Ԫ����)�ܣ����õζ�������ͼ��ʾ(�����Һ������ɿ��ɻ��ǰ��Һ�����֮��)������˵����ȷ���ǣ� ��

A. �����ʾ��Һ�У�c��H+��/c��OH-��=1012
B. �����ʾ��Һ�У�c(K+)+c(H+)=c(HC2O4��)+c(C2O42��)+c(OH��)
C. �����ʾ��Һ�У�c(K+)>c(HC2O4��)>c(H2C2O4)>c(C2O42��)
D. �����ʾ��Һ�У�c(K+)+c(H2C2O4)+c(HC2O4��)+ c(C2O42��)=0.10mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��DΪ�ɶ�����Ԫ����ɵ��������ʣ�������������ʾת����ϵ����DΪǿ�����(����������ʿ���ʡ��)��

����˵������ȷ����
A. ��AΪ�ǽ������ʣ�������Mg��Ӧ�IJ��������������Ӹ����ȿ���Ϊ2:3
B. ��AΪ�ǽ������ʣ��������Ԫ�������ڱ��е�λ�ÿ��ܴ��ڵڶ����ڵ�IVA��
C. ��A�ǹ��ۻ������A��D�п��ܷ���������ԭ��Ӧ
D. ��A�ǽ�����ǽ������ʣ�������0. 1 mol/L��D��Һ����ˮ�������c(H+)����Ϊ10-13mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ��ʯ����ȡ���͵�װ��ʾ��ͼ������ͼʾ�ش��������⡣

(1)ͼ�е��������ԵĴ�����________________��__________________
(2)A������������________��B������������________��
(3)ʵ��ʱ A �г�����ʯ���⣬�����������__________����������__________________��
(4)�ռ������ͺ����ȳ��ƾ��ƻ�����ͣ����ˮ��
______________________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��һֱ�����ڡ��˹��̵����ķ����о�����N2��H2�ϳ�NH3�������仯��ͼ��ʾ��

��1���ϳɰ���Ӧ���Ȼ�ѧ����ʽ_________________________����֪E2=212.4kJ/mol����÷�Ӧ����Ӧ�Ļ����______��
��2����Ӧ��ϵ�м����������Ӧ����______��E2�ı仯��______�������������С�����䡱��
��3����ҵ�ϳ����ø��¸�ѹ��ʹ�ô����ķ����ı�÷�Ӧ�ķ�Ӧ���ʣ��ڼ������������Ϊ2L�̶��ݻ����ܱ������У��ֱ����1molN2��3molH2��1molN2��3molH2��1molHe����Ӧ���ʼ�__�ң�����ڡ�С�ڻ���ڣ���
��4���÷�Ӧ�ġ�S______0��������ڡ�С�ڻ���ڣ�����������______�����¿����Է���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��֥�Ӹ�����ŵ����ѧ���о���Ա�����һ�ֿ�������ҵ��������﮽�����أ���ؽṹ��ͼ��ʾ�� ��ع���ʱ������˵���������
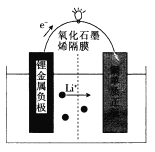
A. ��װ�ý���ѧ��ת��Ϊ����
B. �����Ϸ����ĵ缫��ӦΪLi�� e���� Li��
C. �õ�ؿ���LiOH��Һ�������
D. ��ع���ʱ����·��ÿ����1 mol���ӣ���������7g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������г���MnS����������ȥ��ҵ��ˮ�е�Cu2+��Cu2+��aq��+MnS��s��CuS��s��+Mn2+��aq��������˵��������� ��������
A. MnS��![]() ��CuS��
��CuS��![]() ��
��
B. �÷�Ӧ�ﵽƽ��ʱ��![]()
C. ��ƽ����ϵ�м�������![]() �����
�����![]() ���
���
D. ![]() ����Һ�м�������������
����Һ�м�������������![]() �����
�����![]() ���
���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ�ڹ�ҵ����Ҫ�������쵼�ߡ�����Ԫ���ȣ�ͭ���γɣ�1�ۺͣ�2�۵Ļ����
(1)д����̬Cu���ĺ�������Ų�ʽ___________________________________��
(2)��ͼ��ͭ��ij��������ľ���ʾ��ͼ����������Ļ�ѧʽΪ________��

(3)������ͭ��Һ�еμӰ�ˮ��������ɫ�������ٵμӰ�ˮ�������պ�ȫ���ܽ�ɵõ�����ɫ��Һ�����������м��뼫�Խ�С���Ҵ�������������ɫ��[Cu(NH3)4]SO4��H2O�������������е�NH3ͨ��________������������Cu2����ϣ�NH3������Nԭ�ӵ��ӻ���ʽ��____����NH3���ӻ�Ϊ�ȵ������һ������________��
(4)CuO���۵��CuCl���۵�____(��ߡ��͡�)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com