
【题目】芝加哥伊利诺伊大学的研究人员设计了一种可用于商业化的新型锂金属电池,电池结构如图所示: 电池工作时,下列说法错误的是
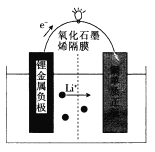
A. 该装置将化学能转化为电能
B. 负极上发生的电极反应为Li- e-= Li+
C. 该电池可用LiOH溶液作电解质
D. 电池工作时,电路中每流过1 mol电子,正极增重7g
科目:高中化学 来源: 题型:
【题目】髙分子聚合物Nomex芳纶(G)耐热性好、强度髙,是一种很好的绝热材料和阻燃纤维,下图是 Nomex芳纶的合成路线图:

(1)A的名称为___________;④的反应类型为___________;G的结构简式为___________。
(2)写出反应②的化学方程式:___________。
(3)B的芳香族同分异构体H具有三种含氧官能团,其各自的特征反应如下:
a.遇FeCl3溶液显紫色;b.可以发生水解反应;c.可发生银镜反应
符合以上性质特点的H共有___________种。
(4)下列有关F的说法正确的是___________(填字母序号)。
A.F的分子式为C14H12N2O3 B.F中只含有氨基和羧基两种官能团
C.F的核磁共振氢谱有11组吸收峰 D.F可以水解得到氨基酸
(5)聚氨基酸类物质以其无毒易降解特性广泛应用于药物载体,已知:CH3 CH2Cl+NH3![]() CH3CH2NH2+HCl,参照G的合成路线图,请以CH3CH2COOH为原料,无机试剂自选,写出合成聚2-氨基丙酸的合成路线图:___________。
CH3CH2NH2+HCl,参照G的合成路线图,请以CH3CH2COOH为原料,无机试剂自选,写出合成聚2-氨基丙酸的合成路线图:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )

A. X是电源的负极
B. 阴极的反应式是:H2O+2eˉ=H2+O2ˉCO2+2eˉ=CO+O2ˉ
C. 总反应可表示为:H2O+CO2H2+CO+O2
D. 阴、阳两极生成的气体的物质的量之比是1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
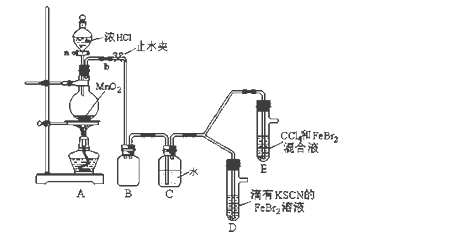
(1)①装置A中发生反应的离子方程式是_____________________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3 是一个可逆反应。
Fe(SCN)3 是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________溶液,若溶液颜色________,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释产生白色沉淀原因__________________、_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能与电能可相互转化,根据下图回答问题。
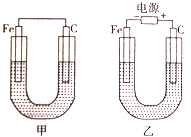
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的______棒,乙装置中的____________棒。(填“铁”或“碳”)
②乙装置中阳极上发生的电极反应式为________________________。
(2)若两装置中均为饱和NaCl溶液:
①甲装置中碳棒上电极反应属于_________________(填“氧化反应”或“还原反应”)。
②乙装置中反应的化学方程式为 __________________。
③若乙装置转移0.1mole-后停止实验,且溶液体积为1L,则溶液混匀后的c(OH-)=_____。(不考虑所生成气体在溶液中的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。

请回答下列问题:
(1)装置F中发生反应的离子方程式是_________________________________________。
(2)装置A的烧瓶中可装试剂_______________________________________________。
(3)B装置的名称是_______________;E装置的作用_____________________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:_______________。
(5)通入C装置的两根导管左边较长、右边较短,目的是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对文中描述内容的相关解释正确的是( )
选项 | 描述 | 解铎 |
A | 丹砂烧之成水银,积变又还成丹砂 | 两个反应互为可逆反应 |
B | 凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之 | 其中“瓦”的主要成分为硅酸盐 |
C | 硝石(KNO3)如握盐雪不冰,强烧之,紫青烟起 | 产生“紫青烟”的原因为KNO3分解 |
D | 其法用浓酒精和槽入瓶,蒸令气上,用器承滴露 | 其中涉及的操作方法为蒸发浓缩 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的 物质的量浓度的负对数与溶液的pH的变化悄况如图所示。

下列说法正确的是( )
A. 曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B. ![]()
C. 溶液中水的电离程度:M>N
D. N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为____________;Al与NaOH溶液反应的离子方程式为____________。
(2)30Si的原子的中子数为________________________。SiO2的晶体类型为_____________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是___________________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是____________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com