
【题目】髙分子聚合物Nomex芳纶(G)耐热性好、强度髙,是一种很好的绝热材料和阻燃纤维,下图是 Nomex芳纶的合成路线图:

(1)A的名称为___________;④的反应类型为___________;G的结构简式为___________。
(2)写出反应②的化学方程式:___________。
(3)B的芳香族同分异构体H具有三种含氧官能团,其各自的特征反应如下:
a.遇FeCl3溶液显紫色;b.可以发生水解反应;c.可发生银镜反应
符合以上性质特点的H共有___________种。
(4)下列有关F的说法正确的是___________(填字母序号)。
A.F的分子式为C14H12N2O3 B.F中只含有氨基和羧基两种官能团
C.F的核磁共振氢谱有11组吸收峰 D.F可以水解得到氨基酸
(5)聚氨基酸类物质以其无毒易降解特性广泛应用于药物载体,已知:CH3 CH2Cl+NH3![]() CH3CH2NH2+HCl,参照G的合成路线图,请以CH3CH2COOH为原料,无机试剂自选,写出合成聚2-氨基丙酸的合成路线图:___________。
CH3CH2NH2+HCl,参照G的合成路线图,请以CH3CH2COOH为原料,无机试剂自选,写出合成聚2-氨基丙酸的合成路线图:___________。
【答案】间二甲苯或1,3-二甲基苯 取代反应 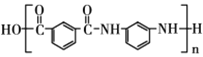
![]() +2HNO3
+2HNO3![]()
 +2H2O 10 AC
+2H2O 10 AC 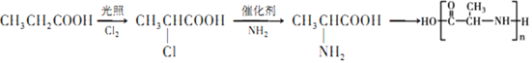 或
或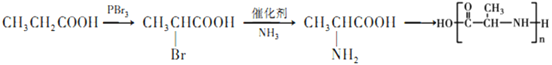 或
或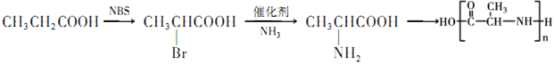 (合理即可)
(合理即可)
【解析】
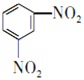
间二甲苯(A)被酸性高锰酸钾溶液氧化生成B,B为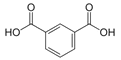 ;苯(C)发生硝化反应生成D,结合E的结构可知,D为
;苯(C)发生硝化反应生成D,结合E的结构可知,D为 ,D发生还原反应生成E,B和E发生成肽反应生成F,F中还原羧基和氨基,可以反应生成高分子化合物G,G为
,D发生还原反应生成E,B和E发生成肽反应生成F,F中还原羧基和氨基,可以反应生成高分子化合物G,G为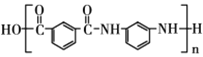 ,据此分析解答。
,据此分析解答。
(1)A的结构简式为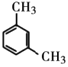 ,名称为间二甲苯或1,3-二甲基苯;反应④是羧基和氨基发生的成肽反应,属于取代反应;G的结构简式为
,名称为间二甲苯或1,3-二甲基苯;反应④是羧基和氨基发生的成肽反应,属于取代反应;G的结构简式为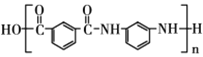 ,故答案为:间二甲苯或1,3-二甲基苯;取代反应;
,故答案为:间二甲苯或1,3-二甲基苯;取代反应;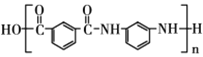 ;
;
(2)反应②为硝化反应,反应的化学方程式为![]() +2HNO3
+2HNO3![]()
 +2H2O,故答案为:
+2H2O,故答案为:![]() +2HNO3
+2HNO3![]()
 +2H2O;
+2H2O;
(3)B为 ,B的芳香族同分异构体H具有三种含氧官能团,其各自的特征反应如下:a.遇FeCl3溶液显紫色,说明一种含氧官能团为酚羟基;b.可以发生水解反应,说明一种含氧官能团为酯基;c.可发生银镜反应,说明一种含氧官能团为醛基;
,B的芳香族同分异构体H具有三种含氧官能团,其各自的特征反应如下:a.遇FeCl3溶液显紫色,说明一种含氧官能团为酚羟基;b.可以发生水解反应,说明一种含氧官能团为酯基;c.可发生银镜反应,说明一种含氧官能团为醛基;
符合以上性质特点的H有:酚羟基与醛基为邻位,酯基有4种位置;酚羟基与醛基为间位,酯基有4种位置;酚羟基与醛基为对位,酯基有2种位置,共10种,故答案为:10;
(4)F为![]() 。A.F的分子式为C14H12N2O3,A正确;B.F中含有氨基、羧基和酰胺键(肽键)三种官能团,B错误;C.F中含有11种氢原子,核磁共振氢谱有11组吸收峰,C正确;D.F可以水解得到
。A.F的分子式为C14H12N2O3,A正确;B.F中含有氨基、羧基和酰胺键(肽键)三种官能团,B错误;C.F中含有11种氢原子,核磁共振氢谱有11组吸收峰,C正确;D.F可以水解得到 和
和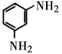 ,得不到氨基酸,D错误;正确的有AC,故答案为:AC;
,得不到氨基酸,D错误;正确的有AC,故答案为:AC;
(5) 以CH3CH2COOH为原料合成聚2-氨基丙酸,首先需要合成 ,在CH3CH2COOH的亚甲基中引入氨基,可以首先引入卤素原子,再利用题中信息CH3 CH2Cl+NH3
,在CH3CH2COOH的亚甲基中引入氨基,可以首先引入卤素原子,再利用题中信息CH3 CH2Cl+NH3![]() CH3CH2NH2+HCl转化为氨基即可,合成路线为
CH3CH2NH2+HCl转化为氨基即可,合成路线为 ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】在恒温恒容中反应:2NO2(g)![]() 2NO(g)+O2(g),能说明反应达平衡状态的是:
2NO(g)+O2(g),能说明反应达平衡状态的是:
①单位时间内生成n mol O2的同时生成2n mol NO2;
②单位时间内生成n mol O2 的同时生成2n mol NO;
③NO2、NO、O2 的反应速率的比为2 : 2 : 1的状态;
④混合气体的颜色不再改变的状态;
⑤混合气体的密度不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态。
A. ①④⑥ B. ②③⑤ C. ①③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)SO2、NOx、CO等气体和可吸入颗粒物对环境的污染尤其严重,为了减少它们对环境的污染,通常采用下列措施进行处理:
已知:①N2(g)+O2(g)![]() 2NO(g) ΔH1=+180 kJ·mol-1
2NO(g) ΔH1=+180 kJ·mol-1
②2CO(g)+O2(g)![]() 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1
可以在汽车的排气管上安装一个催化装置,使汽车尾气中的CO、NO转化成无污染的物质,则该反应热化学方程式为____________________________,该反应自发进行的条件是_________。
(2)通常将SO2经过净化后,与空气进行催化氧化可制硫酸。不同温度下向一恒容密闭容器中通入n(SO2) : n(O2)=2 : 1[2SO2(g)+O2(g)![]() 2SO3(g)],测得容器内总压强与反应时间如图1所示。
2SO3(g)],测得容器内总压强与反应时间如图1所示。

①下列说法不正确的是________;
A.T2>T1 B.该反应正向是吸热反应 C.增大压强一定以使平衡正向移动
D.其他条件不变,向平衡体系中再按物质的量之比为2 : 1充入SO2和O2,达到新的平衡后SO2平衡转化率增大
②图中B点的平衡常数Kp=__________________________(提示:用平衡分压代替平衡浓度计算,平衡分压=总压×物质的量分数)
③ 在压强为p1 MPa下,将2.0 mol SO2(g)和1.0 mol O2(g)充入容积为2 L的密闭容器中,反应达到平衡时,测得SO3气体的体积分数随温度的变化曲线如图所示,请在图中画出p2 MPa(p1<p2 )时平衡体系中SO3气体的体积分数随温度变化的曲线(表明p2 )。 ______________

(3)NH4Cl溶液呈酸性的原因(用相应离子方程式表示)______________________________;常温下,若用pH=3的盐酸滴定pH=11的氨水生成NH4Cl溶液,则用去两溶液的体积关系:V(盐酸)________V(氨水)(填“>”、“=”或“<”),滴定终点的判断:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A、C60和石墨 B、35Cl和37Cl C、![]() 和
和![]()
D、乙醇和甘油 E、CH2=CH-COOH和油酸(C17H33COOH)
①互为同位素的是______________; ②互为同系物的是_________________;
③互为同素异形体的是__________; ④互为同分异构体的是_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:

己知:甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25°C和95℃下溶解度分别为0.3g和6.9g。

i制备产品:将30.0mL甲苯和25.0mLlmol/L高锰酸钾溶液在100°C下反应30min,装置如图所示。
(1)图中冷凝管的进水口为________(填“a”或“b”)。支管的作用是___________________________。
(2)在本实验中,三颈烧瓶最合适的容积__________(填字母)。
A. 50mL B. 100mL C. 200mL D. 250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是____________________________________。
ii分离产品:该同学设计如下流程分离粗产品苯甲酸和回收甲苯

(3)含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是______________;操作Ⅰ的名称是___________。
iii纯度测定
(4)称取1.220g产品,配成100ml甲醇溶液,取25.00mL溶液,用0.1000mol/L KOH溶滴定(与苯甲酸恰好完全反应).重复三次,平均每次消耗KOH溶液的体积23.00mL。样品中苯甲酸纯度为_______。
(5)测定白色固体的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体是苯甲酸与KCl的混合物。应采用___________法对样品提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某钙钛型复合氧化物如图所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
(1)用A,B,O表示这类特殊晶体的化学式:____________________。
(2)已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为__________。
(3)Mn的外围电子排布式为______________。
(4)下列有关说法正确的是________。

A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C60、金刚石和石墨的结构模型如图所示(石墨仅表示其中的一层结构):

(1)C60、金刚石和石墨三者的关系互为___________。
A.同分异构体 B.同素异形体
C.同系物 D.同位素
(2)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是____________
NA个。二氧化硅的结构相当于在硅晶体结构中每个硅硅单键之间插入一个氧原子。二氧化硅的空间网状结构中,硅、氧原子形成的最小环上氧原子数目是___________。
(3)石墨层状结构中,平均每个正六边形拥有的碳原子个数是个___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1KOH溶液滴定10.00mL0.10mol·L-1H2C2O4(二元弱酸)溶,所得滴定曲线如图所示(混合溶液的体积可看成混合前溶液的体积之和)。下列说法正确的是( )

A. 点①所示溶液中:c(H+)/c(OH-)=1012
B. 点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
C. 点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+ c(C2O42-)=0.10mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芝加哥伊利诺伊大学的研究人员设计了一种可用于商业化的新型锂金属电池,电池结构如图所示: 电池工作时,下列说法错误的是
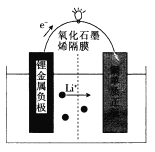
A. 该装置将化学能转化为电能
B. 负极上发生的电极反应为Li- e-= Li+
C. 该电池可用LiOH溶液作电解质
D. 电池工作时,电路中每流过1 mol电子,正极增重7g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com