
【题目】常温下,用0.10mol·L-1KOH溶液滴定10.00mL0.10mol·L-1H2C2O4(二元弱酸)溶,所得滴定曲线如图所示(混合溶液的体积可看成混合前溶液的体积之和)。下列说法正确的是( )

A. 点①所示溶液中:c(H+)/c(OH-)=1012
B. 点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
C. 点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+ c(C2O42-)=0.10mol·L-1
科目:高中化学 来源: 题型:
【题目】杀菌消毒剂 NaClO2的一种生产工艺如下:

下列叙述错误的是
A. NaClO2的化学名称为亚氯酸钠
B. 该法可以利用废气中的SO2减少空气污染
C. 利用Ba(OH)2、Na2CO3能除去粗盐中可溶性杂质
D. ClO2在阴极室得到电子被氧化为 NaClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】髙分子聚合物Nomex芳纶(G)耐热性好、强度髙,是一种很好的绝热材料和阻燃纤维,下图是 Nomex芳纶的合成路线图:

(1)A的名称为___________;④的反应类型为___________;G的结构简式为___________。
(2)写出反应②的化学方程式:___________。
(3)B的芳香族同分异构体H具有三种含氧官能团,其各自的特征反应如下:
a.遇FeCl3溶液显紫色;b.可以发生水解反应;c.可发生银镜反应
符合以上性质特点的H共有___________种。
(4)下列有关F的说法正确的是___________(填字母序号)。
A.F的分子式为C14H12N2O3 B.F中只含有氨基和羧基两种官能团
C.F的核磁共振氢谱有11组吸收峰 D.F可以水解得到氨基酸
(5)聚氨基酸类物质以其无毒易降解特性广泛应用于药物载体,已知:CH3 CH2Cl+NH3![]() CH3CH2NH2+HCl,参照G的合成路线图,请以CH3CH2COOH为原料,无机试剂自选,写出合成聚2-氨基丙酸的合成路线图:___________。
CH3CH2NH2+HCl,参照G的合成路线图,请以CH3CH2COOH为原料,无机试剂自选,写出合成聚2-氨基丙酸的合成路线图:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物J属于大位阻醚系列中的一种物质,在有机化工领域具有十分重要的价值.2018年我国首次使用α-溴代羰基化合物合成大位阻醚J,其合成路线如下:

已知:
回答下列问题:
(1)A 的名称___________________.
(2)C →D的化学方程式_________________________.E →F的反应类型____
(3)H 中含有的官能团________________.J的分子式_______________.
(4)化合物X是D的同分异构体,其中能与氢氧化钠溶液反应的X有_____________种(不考虑立体异构),写出其中核磁共振氢谱有3组峰,峰面积之比为1∶1∶6的结构简式为___________________________.
(5)参照题中合成路线图。涉及以甲苯和 为原料来合成另一种大位阻醚
为原料来合成另一种大位阻醚 的合成路线:__________________。
的合成路线:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组进行电解原理的实验探究,实验如下:一定温度下,以铜为电极,按如图所示装置电解饱和食盐水,通电2min。实验现象:接通电源30s内,阳极附近出现白色浑浊,之后变为橙黄色浑浊,此时测定溶液的pH约为10。结束后(温度不变),试管底部聚集大量红色沉淀,溶液仍为无色。

查阅资料:
物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜(不稳定) | 氯化亚铜 |
颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
下列说法错误的是( )
A. 反应结束后,最终溶液一定呈碱性
B. 反应过程中发生了沉淀转化,说明Ksp(CuOH)<Ksp (CuCl)
C. 阴极的电极反应式为2H2O+2e-=H2↑+2OH-
D. 电解过程中,Cl-移向阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是( )

A. 该燃料电池持续放电时,正极发生氧化反应,pH变大
B. 放电时,电流从a极经过负载流向b极
C. a极的反应式:N2H4+4OH--4e-===N2↑+4H2O
D. 其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )

A. X是电源的负极
B. 阴极的反应式是:H2O+2eˉ=H2+O2ˉCO2+2eˉ=CO+O2ˉ
C. 总反应可表示为:H2O+CO2H2+CO+O2
D. 阴、阳两极生成的气体的物质的量之比是1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
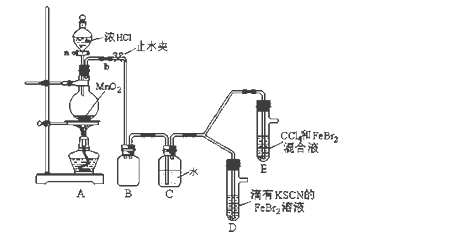
(1)①装置A中发生反应的离子方程式是_____________________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3 是一个可逆反应。
Fe(SCN)3 是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________溶液,若溶液颜色________,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释产生白色沉淀原因__________________、_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的 物质的量浓度的负对数与溶液的pH的变化悄况如图所示。

下列说法正确的是( )
A. 曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B. ![]()
C. 溶液中水的电离程度:M>N
D. N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com