
【题目】用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为____________;Al与NaOH溶液反应的离子方程式为____________。
(2)30Si的原子的中子数为________________________。SiO2的晶体类型为_____________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是___________________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是____________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为____________。
【答案】(1)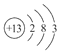 2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)16 (3)HCl (4)CO2 (5)25%
【解析】
试题(1)铝元素的质子数是13,所以Al的原子结构示意图为![]() ;金属铝和氢氧化钠溶液反应生成氢气和偏铝酸钠,反应的方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑。
;金属铝和氢氧化钠溶液反应生成氢气和偏铝酸钠,反应的方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑。
(2)在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,30Si的原子的中子数为30-14=16。
(3)Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的水溶液均显酸性,所以Y是第ⅦA元素。由于氟化氢分子间存在氢键,所以该族氢化物中沸点最低的是HCl。
(4)大理石在高温下分解可以生成CO2,所以使金属不被氧化的气体应该是CO2。
(5)在熔渣中加入盐酸,发生的反应为:Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O,11.0 g为SiO2的质量。在滤液中加入过量NaOH溶液,发生的反应为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl,
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,所得21.4 g固体为Fe(OH)3,根据关系式:
2Fe(OH)3~Fe2O3
214 160
21.4 g m
![]()
解得m=16g
由此可知:Al2O3的质量=36.0 g-11.0 g-16.0 g=9.0g,故Al2O3的质量分数=![]() ×100%=25%。
×100%=25%。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】芝加哥伊利诺伊大学的研究人员设计了一种可用于商业化的新型锂金属电池,电池结构如图所示: 电池工作时,下列说法错误的是
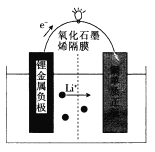
A. 该装置将化学能转化为电能
B. 负极上发生的电极反应为Li- e-= Li+
C. 该电池可用LiOH溶液作电解质
D. 电池工作时,电路中每流过1 mol电子,正极增重7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述不正确的是
A.1.8g 15NH3含有的电子数为NA
B.1L 0.1 mol·L-1硫酸钠溶液中含有的氧原子数为0.4NA
C.常温常压下,8g硝酸铵中含有的氮原子数为0.2NA
D.通常状况下,22.4LCO2和CO的混合气体,其物质的量小于1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1价和+2价的化合物。
(1)写出基态Cu+的核外电子排布式___________________________________。
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为________。

(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过________键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是____。与NH3分子互为等电子体的一种微粒是________。
(4)CuO的熔点比CuCl的熔点____(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空:
(1)3.1g由13C和18O组成的一氧化碳分子,其中含中子_______mol,电子_______个。
(2)现有①4.5gHD ②标准状况下44.8L氩气 ③4℃时9mL水 ④质子数为5NA的甲烷。其中所含原子数最多的是____________(填编号)
(3)下列物质: ①CO2 ②熔融的NaCl ③H2SO4 ④液态氯化氢 ⑤BaSO4 ⑥氯水 ⑦葡萄糖 ⑧ Cu (填编号)
属于电解质的是_________________________;
属于非电解质的是________________________;
能导电的是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g) + H2O(g) ==CO2(g) + 3H2(g) △H = +49 kJmol-1
副反应:H2(g) + CO2(g) ==CO(g) + H2O(g) △H=+41 kJmol-1
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,则该反应的热化学方程式为_________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________。
②分析适当增大水醇比![]() 对甲醇水蒸气重整制氢的好处是_______________。
对甲醇水蒸气重整制氢的好处是_______________。
③某温度下,将n(H2O)∶n(CH3OH) = 1∶1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为____________(忽略副反应)。
(2)工业上用CH4与水蒸气在一定条件下制取H2,原理为:CH4(g) + H2O(g)=CO(g) + 3H2(g) ΔH = + 203 kJmol-1
①该反应逆反应速率表达式为:v逆=kc(CO) c3(H2),k 为速率常数,在某温度下测得实验数据如表:
CO浓度(molL-1) | H2浓度(molL-1) | 逆反应速率(molL-1min-1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.15 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数 k为_________L3mol-3min-1。

②在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示:则压强Pl_______P2(填“大于”或“小于”);N点v正_______M点v逆(填“大于”或“小于”);求Q点对应温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对羟基扁桃酸是农药、药物、香料合成的重要中间体,它可由苯酚和乙醛酸在一定条件下反应制得:

下列说法不正确的是
A. 上述反应的原子利用率可达到100%
B. 在核磁共振氢谱中对羟基扁桃酸应该有6个吸收峰
C. 1mol对羟基扁桃酸与足量NaOH溶液反应,消耗3 mol NaOH
D. 可以用FeCl3溶液鉴别乙醛酸和苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构.晶体中氧的化合价部分为0价,部分为﹣2价.如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元).则下列说法正确的是( )

A. 超氧化钾的化学式为KO2,每晶胞含有14个K+和13个O2﹣
B. 晶体中每个K+周围有8个O2﹣,每个O2﹣周围有8个K+
C. 晶体中与每个K+距离最近的K+有8个
D. 晶体中,0价氧原子与﹣2价氧原子的数目比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是( )

A. 用图甲所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体
B. 按装置乙所示的气流方向可用于收集H2、NO等
C. 用图丙所示装置,分离CCl4萃取碘水后的有机层和水层
D. 用图丁所示装置,可以证明氧化性:Cl2>Br2>I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com