
【题目】填空:
(1)3.1g由13C和18O组成的一氧化碳分子,其中含中子_______mol,电子_______个。
(2)现有①4.5gHD ②标准状况下44.8L氩气 ③4℃时9mL水 ④质子数为5NA的甲烷。其中所含原子数最多的是____________(填编号)
(3)下列物质: ①CO2 ②熔融的NaCl ③H2SO4 ④液态氯化氢 ⑤BaSO4 ⑥氯水 ⑦葡萄糖 ⑧ Cu (填编号)
属于电解质的是_________________________;
属于非电解质的是________________________;
能导电的是_________________________________。
【答案】1.7 1.4NA ① ②③④⑤ ①⑦ ②⑥⑧
【解析】
(1)根据n=m/M计算一氧化碳分子的物质的量,结合分子中含有的中子数、电子数计算中子、电子的物质的量。
(2)先根据物质的量与其它物理量之间的转化关系,将选项中的各量转化成物质的量,根据N=nNA可知物质的量越大,含有的分子数越多,原子的物质的量越大,含有的原子数越多,再根据m=nM进行计算;
(3)电解质是指在水溶液中或熔融状态下能够导电的化合物;非电解质是指在水溶液中和熔融状态下均不导电的化合物;物质能够导电的条件是有自由移动的离子或电子,据此分析作答。
(1)由13C和18O组成的一氧化碳分子的相对分子质量为13+18=31,则3.1g该分子的物质的量为=0.1mol,其中含中子的物质的量为[(13-6)+(18-8)]×0.1mol=1.7mol,电子数为(6+8)×0.1mol×NA mol-1=1.4NA,故答案为:1.7;1.4NA;
(2)①HD的摩尔质量为3g/mol,4.5gHD的原子数为![]() =3NA;
=3NA;
②氩气为单原子分子,标准状况下44.8L氩气的原子数为![]() =2NA;
=2NA;
③水的密度为1g/mL,则4℃时9mL水的质量为9g,其原子个数为![]() =1.5NA;
=1.5NA;
④甲烷的分子式为:CH4,质子数为5NA的甲烷的物质的量为![]() = 0.5 mol,则其原子个数为:0.5 mol
= 0.5 mol,则其原子个数为:0.5 mol![]() 5
5![]() NA mol-1=2.5NA;
NA mol-1=2.5NA;
综上分析,其中所含原子数最多的是①;
(3)①CO2为化合物,不导电,溶于水后形成碳酸而导电,因此CO2属于非电解质;
②熔融NaCl中有自由移动的阴、阳离子,能导电,属于电解质;
③H2SO4不能导电,H2SO4溶于水能导电,H2SO4属于电解质;
④液态氯化氢溶于水后导电,属于电解质;
⑤固体BaSO4不能导电,BaSO4熔融时能导电,BaSO4属于电解质;
⑥氯水为氯气溶于水所得的溶液,能导电,但氯水属于混合物,既不是电解质也不是非电解质;
⑦葡萄糖在水中以分子形式存在,不导电,属于非电解质;
⑧Cu能导电,Cu属于单质,既不是电解质也不是非电解质;
综上所述,属于电解质的是②③④⑤;属于非电解质的是①⑦;能导电的是②⑥⑧。


科目:高中化学 来源: 题型:
【题目】化学能与电能可相互转化,根据下图回答问题。
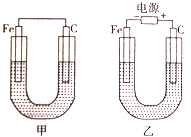
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的______棒,乙装置中的____________棒。(填“铁”或“碳”)
②乙装置中阳极上发生的电极反应式为________________________。
(2)若两装置中均为饱和NaCl溶液:
①甲装置中碳棒上电极反应属于_________________(填“氧化反应”或“还原反应”)。
②乙装置中反应的化学方程式为 __________________。
③若乙装置转移0.1mole-后停止实验,且溶液体积为1L,则溶液混匀后的c(OH-)=_____。(不考虑所生成气体在溶液中的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各离子浓度关系正确的是
A. pH=2的醋酸溶液与pH=12的氢氧化钠溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B. 浓度为0.1 mol·L-1的碳酸氢钠溶液:c(Na+)+ c(H+)=c(HCO3-)+c(OH-)
C. 浓度为0.1 mol·L-1的(NH4)2CO3溶液:c(NH4+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D. 浓度均为0.1 mol·L-1的醋酸溶液与NaOH溶液混合后:c(OH-)=c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某化学反应过程中,生成物的量与时间的关系,图中a、b、c三条曲线不能反映下列哪种因素对生成物的量的影响( )

A. 不同的温度 B. 不同的pH值
C. 不同的底物浓度 D. 不同的酶浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X元素是地壳中含量最多的元素,Y元素是空气中含量最多的元素,A元素与Y同主族,且是该主族中原子序数最大的非金属元素,D元素位于周期表中第三周期,其最高氧化态可与A形成D3A2。下列说法错误的是
A. 对应酸的酸性:A2X5<A2X3B. 简单离子半径:A>Y>X>D
C. A元素的原子结构示意图: D. 非金属性:X>Y
D. 非金属性:X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为____________;Al与NaOH溶液反应的离子方程式为____________。
(2)30Si的原子的中子数为________________________。SiO2的晶体类型为_____________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是___________________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是____________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF![]() 的立体构型为________;
的立体构型为________;
②在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(2)①Y2X2(C2H2)分子中Y原子轨道的杂化类型为______,1 mol Y2X2含有σ键的数目为______。
②元素Y(C)的一种氧化物与元素Z(N)的一种氧化物互为等电子体,元素Z的这种氧化物的分子式为________。
③化合物ZX3(NH3)的沸点比化合物YX4(CH4)的高,其主要原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是重要的化工原料,也是清洁的能源。
Ⅰ、工业上,在一定条件下用乙烯水化法制备乙醇。已知热化学方程式如下:
①CH2=CH2(g)+H2O(g)CH3CH2OH(g) ΔH1
②2CH2=CH2(g)+H2O(g)CH3CH2OCH2CH3(g) ΔH2
③2CH3CH2OH(g)CH3CH2OCH2CH3(g)+H2O(g) ΔH3
(1)几种化学键的键能如下:
化学键 | H-C | C=C | H-O | C-O | C-C |
键能kJ·mol-1 | 413 | 615 | 463 | 351 | 348 |
根据键能计算ΔH1=________________kJ·mol-1。
(2)在恒容密闭容器中发生反应②,下列能说明该反应达到平衡的是_________。
a、容器中总压强保持不变
b、H2O(g)的消耗速率与CH3CH2OCH2CH3(g)生成速率相等
c、气体平均摩尔质量保持不变
d、容器中气体密度保持不变
(3)在密闭容器中投入CH2=CH2(g)、H2O(g)和催化剂发生反应①,乙烯的平衡转化率与温度、压强的关系如图所示。

①x代表________________。(选填“温度”或“压强”)
②L1和L2哪个大?并请说出理由:_____________________________________________________。
Ⅱ、如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和lmolHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:

(4)达到平衡时,隔板K最终停留在0刻度左侧某一处,记为a处,则a的取值范围是__________。
(5)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,则该反应化学平衡常数为_______________。
(6)若一开始就将K、F如上图固定,其他条件均不变,则达到平衡时:测得甲中A的转化率为b,则乙中C的转化率为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com