
【题目】以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g) + H2O(g) ==CO2(g) + 3H2(g) △H = +49 kJmol-1
副反应:H2(g) + CO2(g) ==CO(g) + H2O(g) △H=+41 kJmol-1
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,则该反应的热化学方程式为_________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________。
②分析适当增大水醇比![]() 对甲醇水蒸气重整制氢的好处是_______________。
对甲醇水蒸气重整制氢的好处是_______________。
③某温度下,将n(H2O)∶n(CH3OH) = 1∶1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为____________(忽略副反应)。
(2)工业上用CH4与水蒸气在一定条件下制取H2,原理为:CH4(g) + H2O(g)=CO(g) + 3H2(g) ΔH = + 203 kJmol-1
①该反应逆反应速率表达式为:v逆=kc(CO) c3(H2),k 为速率常数,在某温度下测得实验数据如表:
CO浓度(molL-1) | H2浓度(molL-1) | 逆反应速率(molL-1min-1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.15 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数 k为_________L3mol-3min-1。

②在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示:则压强Pl_______P2(填“大于”或“小于”);N点v正_______M点v逆(填“大于”或“小于”);求Q点对应温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
【答案】CH3OH(g)![]() CO(g)+2H2(g) ΔH = +90 kJ/mol 升温 提高甲醇的利用率、有利于抑制CO的生成或抑制副反应发生
CO(g)+2H2(g) ΔH = +90 kJ/mol 升温 提高甲醇的利用率、有利于抑制CO的生成或抑制副反应发生 ![]() ×100% 1.2×104 大于 小于 48 (mol/L)2 正反应方向
×100% 1.2×104 大于 小于 48 (mol/L)2 正反应方向
【解析】
(1)①根据盖斯定律计算所求反应的焓变,从压强和温度角度分析措施;
②适当增大水醇比[n(H2O):n(CH3OH)],可视为增大H2O的量,能使CH3OH转化率增大,生成更多的H2,抑制转化为CO的反应的进行;
③根据主反应方程式计算,平衡体系总压为各组分分压之和;
(2)①根据v逆=kc(CO)c3(H2)计算k的值;
②反应为气体分子数增多的反应,随着反应的进行,体系压强增大,增大压强不利于反应正向进行,反应为吸热反应,温度升高有利于反应正向进行,化学反应平衡时的正反应和逆反应速率相等;根据温度高、压强大使化学反应速率加快分析M、N点速率大小;利用三段式计算平衡时各种物质的物质的量,结合容器的容积得到相应物质的平衡浓度,根据平衡常数表达式可得其平衡常数的数值。然后将加入1 mol CH4和1 mol CO加入反应体系,计算此时的Qc并与K比较,判断平衡移动的方向。
(1)①已知:①CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H = +49 kJ/mol,
CO2(g)+3H2(g) △H = +49 kJ/mol,
②H2(g)+CO2(g)![]() CO(g)+H2O(g) △H=+41kJ/mol,
CO(g)+H2O(g) △H=+41kJ/mol,
根据盖斯定律,反应可由①+②整理可得,CH3OH(g)![]() CO(g)+2H2(g)△H=△H1+△H2=+90kJ/mol;该反应为吸热反应,升高温度既能加快化学反应速率同时可以促使反应正向进行,提高CH3OH平衡转化率,而增大压强能加快化学反应速率,但对正反应不利,所以既能加快反应速率又能提高CH3OH平衡转化率的一种措施是升高温度;
CO(g)+2H2(g)△H=△H1+△H2=+90kJ/mol;该反应为吸热反应,升高温度既能加快化学反应速率同时可以促使反应正向进行,提高CH3OH平衡转化率,而增大压强能加快化学反应速率,但对正反应不利,所以既能加快反应速率又能提高CH3OH平衡转化率的一种措施是升高温度;
②适当增大水醇比[n(H2O):n(CH3OH)],可视为增大H2O的量,能使CH3OH转化率增大,生成更多的H2,抑制转化为CO的反应的进行,所以适当增大水醇比[n(H2O):n(CH3OH)]对甲醇水蒸气重整制氢的好处为:提高甲醇的利用率,有利于抑制CO的生成;
③主反应为:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g),n(H2O):n(CH3OH)=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,
CO2(g)+3H2(g),n(H2O):n(CH3OH)=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,
CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)
CO2(g)+3H2(g)
初始压强 0.5p1 0.5p1
转化压强 p p p 3p
平衡压强 0.5p1-p 0.5p1-p p 3p
所以可得p2=(0.5p1-p)+(0.5p1-p)+ p+3p=p1+2p,故p=![]() ,则平衡时甲醇的转化率为α=
,则平衡时甲醇的转化率为α=![]() ×100%
×100%
(2)①根据v逆=kc(CO)c3(H2),由表中数据,c13=![]() mol3/L3,则c2=
mol3/L3,则c2=![]() =0.2mol/L,所以k=
=0.2mol/L,所以k=![]() L3mol3min1=1.2×104 L3mol3min1;
L3mol3min1=1.2×104 L3mol3min1;
②反应为气体分子数增多的反应,随着反应的进行,体系压强增大,增大压强不利于反应正向进行,所以压强p1大于p2;M、N都处于平衡状态,该点的正反应速率等于逆反应速率。由于温度:M>N,压强:M>N,升高温度或增大压强都会使化学反应速率加快,因此N点v正<M点v逆;
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
起始(mol) 3 3 0 0
转化(mol) -x -x x 3x
平衡(mol) 3-x 3-x x 3x
所以可得![]() =60%,解得x=2,所以平衡时c(CH4)=
=60%,解得x=2,所以平衡时c(CH4)=![]() =
=![]() mol/L,c(H2O)=
mol/L,c(H2O)=![]() mol/L,c(CO)=
mol/L,c(CO)=![]() mol/L,c(H2)=2mol/L,则化学平衡常数为K=
mol/L,c(H2)=2mol/L,则化学平衡常数为K= =48mol2/L2;
=48mol2/L2;
若平衡后再向容器中加入1 mol CH4和1 mol CO,则c(CH4)=![]() mol/L,c(CO)=1mol/L,Qc=
mol/L,c(CO)=1mol/L,Qc=![]() <K,所以化学平衡正向移动直至达到化学平衡。
<K,所以化学平衡正向移动直至达到化学平衡。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。

请回答下列问题:
(1)装置F中发生反应的离子方程式是_________________________________________。
(2)装置A的烧瓶中可装试剂_______________________________________________。
(3)B装置的名称是_______________;E装置的作用_____________________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:_______________。
(5)通入C装置的两根导管左边较长、右边较短,目的是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H是一种重要的高分子化合物,其合成路线如下:
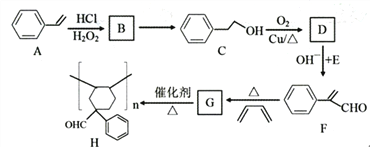
已知:
请回答下列问题:
(1)A的名称是_______________,C中含氧官能团名称是______________。
(2)写出反应类型:A→B______________,C→D__________________。
(3)B→C的反应试剂和反应条件是______________________。
(4)D+E→F的反应方程式是_________________。
(5)G的分子式是____________________。
(6)满足下列条件的F的同分异构体共有__________种(不考虑立体异构)。
a.苯环上有两个取代基,无其他环状结构;b.含碳碳三键,无-C≡COH结构。
(7)多环化合物是有机研究的重要方向,请设计由![]() 、.CH3CHO、
、.CH3CHO、![]() -CHO合成多环化合物
-CHO合成多环化合物 的路线(无机试剂任选)______________
的路线(无机试剂任选)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醛分子的模型,根据该图和所学化学知识回答下列问题:
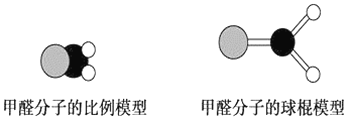
(1)甲醛分子中碳原子的杂化方式是__________,作出该判断的主要理由是__________________________。
(2)下列是对甲醛分子中碳氧键的判断,其中正确的是________(填序号)。
①单键 ②双键 ③σ键 ④π键 ⑤σ键和π键
(3)甲醛分子中C—H键与C—H键间的夹角________(填“=”、“>”或“<”)120°,出现该现象的主要原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为____________;Al与NaOH溶液反应的离子方程式为____________。
(2)30Si的原子的中子数为________________________。SiO2的晶体类型为_____________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是___________________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是____________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A. 制乙酸乙酯时,将乙醇注入浓硫酸中,冷却后加入乙酸
B. 向溴乙烷中滴加硝酸酸化的AgNO3溶液,以检验其中的溴元素
C. 用氢氧化钠溶液清洗盛过苯酚的试管
D. 在试管中加入2mL2%的CuSO4溶液,然后加入4至6滴10%的NaOH溶液振荡、再加入几滴乙醛溶液加热煮沸,可以检验乙醛分子中的醛基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废镍催化剂中主要有Ni,还有Al、Fe、SiO2及其它不溶于酸、碱的杂质。现用废镍催化剂制备NiSO4·7H2O晶体,其流程如下图:

已知:Ksp[Fe(OH)3]=8.0×10-38,Ka sp[Fe(OH)2]=8.0×10-16,K[Al(OH)3]=3.2×10-34,Ksp[Ni(OH)2]=2.0×10-15,1g2=0.3,
回答下列问题
(1)“碱浸”的目的是______。
(2)“酸浸时发生的离子方程式为Fe+2H+=Fe2++H2↑、_______。
(3)“净化除杂需要先加入H2O2溶液,发生反应的离子方程式为______,然后调节PH=_______时,使杂质离子恰好完全沉淀(注:离子浓度小于或等于1×10-5mol/L时沉淀完全)
(4)“操作A为”______。
(5)Ni2+在强碱性溶液中还可被NaClO氧化为NiOOH,该反应离子方程式为______。
(6) NiOOH也可作为原电池的电极材料,若在碱性条件下形成燃料电池,负极通入N2H4气体,则负极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是____(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料红氧化铁的工艺流程如下(部分操作和条件略):
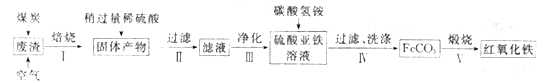
①在步骤Ⅰ中产生的有毒气体可能有_____________________。
②在步骤Ⅲ操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+ 沉淀完全,则溶液的pH为_________。(c(Al3+)≤1.0×10-5mol/L 视为Al3+沉淀完全)
③步骤Ⅳ中,生成FeCO3的离子方程式是____________________________。
(3)氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式______________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:__________________________________________________________。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应Ⅱ的离子方程式是____________________________________________。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN-,方案如下:

若试纸交蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5,依次发生分解反应:①N2O5(g)![]() N2O3(g)+O2(g)、②N2O3(g)
N2O3(g)+O2(g)、②N2O3(g)![]() N2O(g)+O2(g)。在体积为2 L的恒容密闭容器中充入8 mol N2O5,加热到T ℃时反应达到平衡状态,此时O2和N2O3的物质的量分别为9 mol、3.4 mol,则T ℃时反应①的平衡常数为
N2O(g)+O2(g)。在体积为2 L的恒容密闭容器中充入8 mol N2O5,加热到T ℃时反应达到平衡状态,此时O2和N2O3的物质的量分别为9 mol、3.4 mol,则T ℃时反应①的平衡常数为
A. 10.7 B. 8.5 C. 9.6 D. 10.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com