
【题目】如图是甲醛分子的模型,根据该图和所学化学知识回答下列问题:
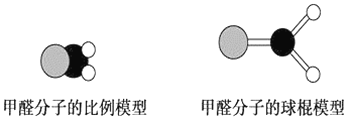
(1)甲醛分子中碳原子的杂化方式是__________,作出该判断的主要理由是__________________________。
(2)下列是对甲醛分子中碳氧键的判断,其中正确的是________(填序号)。
①单键 ②双键 ③σ键 ④π键 ⑤σ键和π键
(3)甲醛分子中C—H键与C—H键间的夹角________(填“=”、“>”或“<”)120°,出现该现象的主要原因是____________________________________________。
【答案】sp2 甲醛分子的空间构型为平面三角形 ②⑤ < 碳氧双键中存在π键,它对C—H键的排斥作用较强
【解析】
(1) 甲醛分子为平面三角形,甲醛分子中的碳原子采用sp2杂化;
(2)醛类分子中都含有C=O键,所以甲醛分子中的碳氧键是双键,双键中含有σ键和π键;
(3)由于碳氧双键中存在π键,它对C—H键的排斥作用较强,键角小于120°。
(1)原子的杂化轨道类型不同,分子的空间构型也不同。由图可知,甲醛分子为平面三角形,所以甲醛分子中的碳原子采用sp2杂化;综上所述,本题答案是:sp2 ;甲醛分子的空间构型为平面三角形。
(2)醛类分子中都含有C=O键,所以甲醛分子中的碳氧键是双键;一般来说,双键是σ键和π键的组合,②⑤正确;综上所述,本题答案是:②⑤。
(3)由于碳氧双键中存在π键,它对C—H键的排斥作用较强,所以甲醛分子中C—H键与C—H键间的夹角小于120°;综上所述,本题答案是:< ,碳氧双键中存在π键,它对C—H键的排斥作用较强。


科目:高中化学 来源: 题型:
【题目】科学家一直致力于“人工固氮”的方法研究.用N2和H2合成NH3的能量变化如图所示。

(1)合成氨反应的热化学方程式_________________________,已知E2=212.4kJ/mol,则该反应正反应的活化能是______。
(2)反应体系中加入催化剂,反应速率______,E2的变化是______。(填“增大”、“减小”或“不变”)
(3)工业上常采用高温高压,使用催化剂的方法改变该反应的反应速率,在甲乙两个体积均为2L固定容积的密闭容器中,分别充入1molN2、3molH2和1molN2、3molH2、1molHe,反应速率甲__乙(填大于、小于或等于)。
(4)该反应的△S______0,(填大于、小于或等于),理论上在______条件下可以自发。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是

A. T1>T2 △H > 0
B. 该反应进行到M点放出的热量等于进行到W点放出的热量
C. M点的正反应速率v(正)大于N点的逆反应速率v(逆)
D. M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:


回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为___________________。“酸浸”实验中为了提高酸浸的效率,除了升温还可以采取的措施有___________________(至少写两种)。
(2)“酸浸”后,“滤液①”钛主要以![]() 形式存在,写出其水解生成TiO2·xH2O的离子方程式__________________。
形式存在,写出其水解生成TiO2·xH2O的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40 ℃时TiO2·xH2O转化率最高的原因__________________。
(4)若“滤液②”中![]() ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使![]() 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中![]() ,此时是否有Mg3(PO4)2沉淀生成?_____________(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为
,此时是否有Mg3(PO4)2沉淀生成?_____________(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1价和+2价的化合物。
(1)写出基态Cu+的核外电子排布式___________________________________。
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为________。

(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过________键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是____。与NH3分子互为等电子体的一种微粒是________。
(4)CuO的熔点比CuCl的熔点____(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)下列关于金属及金属键的说法不正确的是______。(填字母代号)
a.金属键没有方向性与饱和性
b.金属键是金属原子与自由电子间的相互作用
c.金属熔沸点不同的原因可以用金属键强弱解释
d.电子气理论可解释金属材料的延展性,不能解释金属有良好的导电性
(2)钒广泛用于催化及钢铁工业,基态钒原子的价层电子排布图为_________________。
(3)二茂铁又叫双环戊二烯基铁[Fe(C5H5)2],熔点是172.5~173 ℃,100 ℃以上升华,二茂铁属于_____晶体。已知分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() )。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
)。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
(4)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行______实验,其中阴离子的空间构型是_____,该化合物加热时首先失去的组分是H2O,原因是_______________________。
(5)最近发现,只含镁、镍和碳三种元素的晶体也具有超导性,该物质形成的晶体的立方晶胞结构如图所示。
①与Mg紧邻的Ni有________个。
②原子坐标参数可表示晶胞内部各原子的相对位置。该晶胞中原子的坐标参数为a为(0,0,0);b为(1/2,1/2,0);d为(1,1,1)。则c原子的坐标参数为_______。
③若晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g·cm-3(用含a、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g) + H2O(g) ==CO2(g) + 3H2(g) △H = +49 kJmol-1
副反应:H2(g) + CO2(g) ==CO(g) + H2O(g) △H=+41 kJmol-1
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,则该反应的热化学方程式为_________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________。
②分析适当增大水醇比![]() 对甲醇水蒸气重整制氢的好处是_______________。
对甲醇水蒸气重整制氢的好处是_______________。
③某温度下,将n(H2O)∶n(CH3OH) = 1∶1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为____________(忽略副反应)。
(2)工业上用CH4与水蒸气在一定条件下制取H2,原理为:CH4(g) + H2O(g)=CO(g) + 3H2(g) ΔH = + 203 kJmol-1
①该反应逆反应速率表达式为:v逆=kc(CO) c3(H2),k 为速率常数,在某温度下测得实验数据如表:
CO浓度(molL-1) | H2浓度(molL-1) | 逆反应速率(molL-1min-1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.15 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数 k为_________L3mol-3min-1。

②在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示:则压强Pl_______P2(填“大于”或“小于”);N点v正_______M点v逆(填“大于”或“小于”);求Q点对应温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度 2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。填写下列空白:
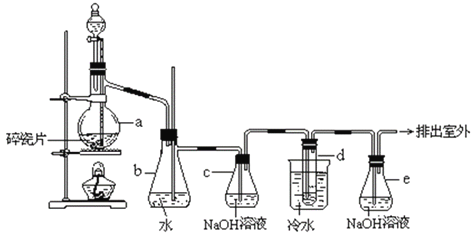
(1) 写出本题中由乙醇制备1,2-二溴乙烷的两个化学反应方程式:
①____________________________________________,反应类型为________________。
②____________________________________________,反应类型为________________。
(2)装置b可以充当安全瓶,防止倒吸,例如:若装置a、b上方气体压强减小,则装置b中的现象为________________________________________________________________。
(3)容器c中NaOH溶液的作用是:________________________________;若无c装置,则d中发生副反应的离子方程式为________________________________________。
(4)在做此实验时,应使a装置中的液体温度迅速升高到所需温度,请用化学方程式表示其原因_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒及其他钒的化合物广泛应用于钢铁、有色合金、化工、炼油、玻璃及陶瓷等工业部门。可从含钒石煤灰渣中提钒,该试验工艺流程如下图:

表1 灰渣主要化学成分分析/%
V2O3 | SiO2 | Fe2O3 | Al2O3 | MgO | K2O | CaO | 烧失量 |
1.26 | 55.71 | 6.34 | 7.54 | 1.26 | 3.19 | 1.41 | 20.55 |
表2中间盐主要成分分析/%(以氧化物形式表示其含量)
V2O3 | Al2O3 | Fe2O3 | MgO | K2O |
5.92 | 1.70 | 18.63 | 2.11 | 3.38 |
已知:
①石煤灰渣的化学成分分析见表1,中间盐的主要成分分析见表2。
②矿物焙烧过程中,若温度过高,易发生烧结,温度越高,烧结现象越严重。
③萃取反应可以表示为:VO2++(HR2)PO4(o)→VO[R2PO4]R(o)+H+,(o)表示有机相
④有机萃取剂(HR2)PO4萃取VO2+的能力比萃取V02+要强。
请回答:
(1)提高浸取率的方法有____________,残渣的主要成分为______________________,
(2)经几级萃取后,有时候要适当加酸调整pH值,结合萃取反应方程式,说明原因_____________。反萃取操作应加入_____________试剂。
(3)中间盐溶解过程中,加铁粉的主要目的是_____________________。
(4)石煤中的钒以V(Ⅲ)为主,有部分V(Ⅳ),很少见V(Ⅴ)。如图1和如图2分别为焙烧温度和焙烧时间对钒浸出率的影响,由如图2可得最佳焙烧时间为______________h,由如图1可得最佳焙烧温度为800-850℃之间,焙烧温度在850℃以下时,钒浸出率随焙烧温度的上升几乎直线上升的原因是_________________________,当焙烧温度高超过850℃以后,再提高温度,浸出率反而下降的可能原因是:_________________________。

(5)反萃取液中的VO2+,加入氯酸钠后被氧化为VO2+,请写出该反应的离子方程式______________。然后用氨水调节pH到1.9~2.2沉钒,得多钒酸铵沉淀(化学式为(NH4)2V12O31·nH2O),再经固液分离、干燥、焙烧得五氧化二钒产品,请写出此步反应的化学方程式____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com