
【题目】金属及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)下列关于金属及金属键的说法不正确的是______。(填字母代号)
a.金属键没有方向性与饱和性
b.金属键是金属原子与自由电子间的相互作用
c.金属熔沸点不同的原因可以用金属键强弱解释
d.电子气理论可解释金属材料的延展性,不能解释金属有良好的导电性
(2)钒广泛用于催化及钢铁工业,基态钒原子的价层电子排布图为_________________。
(3)二茂铁又叫双环戊二烯基铁[Fe(C5H5)2],熔点是172.5~173 ℃,100 ℃以上升华,二茂铁属于_____晶体。已知分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() )。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
)。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
(4)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行______实验,其中阴离子的空间构型是_____,该化合物加热时首先失去的组分是H2O,原因是_______________________。
(5)最近发现,只含镁、镍和碳三种元素的晶体也具有超导性,该物质形成的晶体的立方晶胞结构如图所示。
①与Mg紧邻的Ni有________个。
②原子坐标参数可表示晶胞内部各原子的相对位置。该晶胞中原子的坐标参数为a为(0,0,0);b为(1/2,1/2,0);d为(1,1,1)。则c原子的坐标参数为_______。
③若晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g·cm-3(用含a、NA的代数式表示)。

【答案】 bd 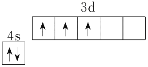 分子
分子 ![]() X-射线衍射 正四面体 H2O与Cu2+的配位键比NH3与Cu2+的弱 12 (1,1/2,1/2)
X-射线衍射 正四面体 H2O与Cu2+的配位键比NH3与Cu2+的弱 12 (1,1/2,1/2) ![]()
【解析】
(1)a.金属键是金属阳离子和自由电子间的相互作用,金属键没有方向性与饱和性,a正确;b.金属键是金属阳离子和自由电子间的相互作用,b错误;c.金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,金属的熔沸点不同的原因可以用金属键强弱解释,c正确;d.金属导电是因为自由电子在外加电场作用下发生定向移动,可用电子气理论解释,d错误,答案选bd;(2)钒是23号元素,基态钒原子的价层电子排布图为 。(3)二茂铁熔点是172.5~173℃,100℃以上升华,因此二茂铁属于分子晶体。因为每个环戊二烯中含有5个C原子,且二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为
。(3)二茂铁熔点是172.5~173℃,100℃以上升华,因此二茂铁属于分子晶体。因为每个环戊二烯中含有5个C原子,且二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为![]() 。(4)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行X-射线衍射实验,其中阴离子是硫酸根,其空间构型是正四面体。由于H2O与Cu2+的配位键比NH3与Cu2+的弱,所以该化合物加热时首先失去的组分是H2O。(5)①根据晶胞结构可知与Mg紧邻的Ni有
。(4)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行X-射线衍射实验,其中阴离子是硫酸根,其空间构型是正四面体。由于H2O与Cu2+的配位键比NH3与Cu2+的弱,所以该化合物加热时首先失去的组分是H2O。(5)①根据晶胞结构可知与Mg紧邻的Ni有![]() 个。②该晶胞中原子的坐标参数为a为(0,0,0);b为(1/2,1/2,0);d为(1,1,1),则c原子的坐标参数为(1,1/2,1/2)。③若晶胞中Ni、Mg之间的最短距离为a pm,则面对角线是2a pm,边长是
个。②该晶胞中原子的坐标参数为a为(0,0,0);b为(1/2,1/2,0);d为(1,1,1),则c原子的坐标参数为(1,1/2,1/2)。③若晶胞中Ni、Mg之间的最短距离为a pm,则面对角线是2a pm,边长是![]() ,则晶体的密度
,则晶体的密度![]() g·cm-3。
g·cm-3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)在下列化学方程式中,双线桥法标出电子转移并填空。3S+6KOH![]() K2SO3+2K2S+3H2O___,氧化剂___,还原剂___;2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑___,氧化剂___,被氧化的物质_____;3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O___,被还原的物质_____,还原剂______。
K2SO3+2K2S+3H2O___,氧化剂___,还原剂___;2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑___,氧化剂___,被氧化的物质_____;3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O___,被还原的物质_____,还原剂______。
(2)请把符合要求的化学反应方程式的编号填入括号内:是分解反应又是氧化还原反应的是___,是分解反应不是氧化还原反应的是___,是化合反应又是氧化还原反应的是___,是化合反应不是氧化还原反应的是___,不属于四种基本反应类型的氧化还原反应的是___。
A.2KClO3![]() 2KCl+3O2↑ B.2Fe+3Cl2
2KCl+3O2↑ B.2Fe+3Cl2![]() 2FeCl3 C.NH4HCO3
2FeCl3 C.NH4HCO3![]() NH3↑+H2O+CO2↑D.CaO+CO2=CaCO3 E.Cl2+H2O=HCl+HClO
NH3↑+H2O+CO2↑D.CaO+CO2=CaCO3 E.Cl2+H2O=HCl+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1为“镁﹣次氯酸盐”燃料电池原理示意图。图2为“双极室成对电解法”生产乙醛酸原理示意图,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法不正确的是

A. 若利用镁燃料电池为电源,则E极连M极
B. 镁燃料电池负极容易与水发生自腐蚀产生氢气
C. F电极上的电极反应式为ClO-+2e-+H2O=Cl-+2OH-
D. 图2装置中若有2 mol H+通过质子交换膜完全反应,则共生成2 mol乙醛酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1 mol·L-1 FeCl3溶液与0.01 mol·L-1 KSCN溶液等体积混合,发生如下反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,改变下列条件,能使溶液颜色变浅的是
Fe(SCN)3+3KCl,改变下列条件,能使溶液颜色变浅的是
A. 向溶液中加入少量KCl晶体 B. 向溶液中加入一定量KCl溶液
C. 向溶液中加入少量AgNO3固体 D. 向溶液中滴加几滴1 mol·L-1 FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示测定溶液导电性实验的装置,甲与乙中盛有浓度相同的不同液体。接通电源后将甲中液体逐滴滴入乙中,发现灯泡由亮→暗灭→亮。下表中甲、乙所盛液体符合要求的是( )

选项 | 甲 | 乙 |
A | 氯化钠溶液 | 硝酸银溶液 |
B | 氨水 | 醋酸 |
C | 稀盐酸 | 碳酸钙悬浊液 |
D | 硫酸铜溶液 | 氢氧化钡溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室利用少量Cu片和过量浓硝酸制取NO2气体的装置。
(1)烧瓶中产生气体的颜色是_________;

(2)反应结束后,将烧瓶浸入冰水中,发生反应2NO2(g)![]() N2O4(g)ΔH=-53kJ/mol。此时烧瓶内气体颜色______(填“变深”、“不变”或“变浅”),使用相关化学用语和必要的文字说明颜色变化的原因__________________________________。
N2O4(g)ΔH=-53kJ/mol。此时烧瓶内气体颜色______(填“变深”、“不变”或“变浅”),使用相关化学用语和必要的文字说明颜色变化的原因__________________________________。
(3)在80℃时,将0.40molN2O4气体充入2L已经抽成真空的固定容积的密闭容器I中发生反应,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4)/mol | 0.40 | a | 0.20 | c | d | e |
n(NO2)/mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
①计算a=_________,此温度时该反应(N2O4作为反应物)的平衡常数K=_________。
反应达平衡时,共吸收热量________kJ。
②在其他条件不变时,改变条件,使反应再次达到平衡,能使c(NO2)/c(N2O4)比值变小的措施有(填字母)________。
A.降低温度 B.使用高效催化剂
C.升高温度 D.通入稀有气体,使容器内压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g)![]() 2NO(g) △H1=+183kJ/mol
2NO(g) △H1=+183kJ/mol
2H2(g)+O2(g)=2H2O(1) △H2=-571.6kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H3=-1164.4kJ/mol
则N2(g)+3H2(g)![]() 2NH3(g) △H=________kJ/mol
2NH3(g) △H=________kJ/mol
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料I | 1.0mol/L | 3.0mol/L | 0 |
投料II | 0.5mol/L | 1.5mol/L | 1.0mol/L |
①按投料I进行反应,测得达到化学平衡状态时H2的转化率为40%,若按投料II进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)。
②L(L1、L2)、X可分别代表压强或温度。如图表示L一定时,合成氨反应中H2(g)的平衡转化率随X
的变化关系。
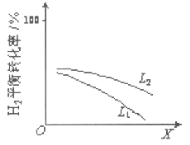
iX代表的物理量是_________,
ii判断L1、L2的大小关系,并简述理由:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验目的 | 探究Na2CO3和NaHCO3溶解度的相对大小 | 用已知浓度的NaOH溶液滴定未知浓度的稀硫酸 | 检验蔗糖与浓硫酸反应产生的CO2 | 验证镁和稀盐酸的反应的热效应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如图,下列叙述不正确的是( )

A. 有机物A属于芳香族化合物
B. 有机物A和NaOH的醇溶液共热可发生消去反应
C. 有机物A和浓硫酸混合加热,可以发生消去反应
D. 1molA和足量的NaOH溶液反应,最多可以消耗 3molNaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com