
【题目】科学家一直致力于“人工固氮”的方法研究.用N2和H2合成NH3的能量变化如图所示。

(1)合成氨反应的热化学方程式_________________________,已知E2=212.4kJ/mol,则该反应正反应的活化能是______。
(2)反应体系中加入催化剂,反应速率______,E2的变化是______。(填“增大”、“减小”或“不变”)
(3)工业上常采用高温高压,使用催化剂的方法改变该反应的反应速率,在甲乙两个体积均为2L固定容积的密闭容器中,分别充入1molN2、3molH2和1molN2、3molH2、1molHe,反应速率甲__乙(填大于、小于或等于)。
(4)该反应的△S______0,(填大于、小于或等于),理论上在______条件下可以自发。
【答案】N2(g)+3H2(g)![]() 2 NH3(g) △H2= -92.4kJmol-1 120 kJmol-1 增大 减小 等于 小于 低温
2 NH3(g) △H2= -92.4kJmol-1 120 kJmol-1 增大 减小 等于 小于 低温
【解析】
(1)根据图示,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ的热量,据此书写反应的热化学方程式;根据反应热=正反应的活化能-逆反应的活化能计算正反应的活化能;
(2)催化剂能够降低反应的活化能,加快反应速率,据此分析判断;
(3)由于容器的体积不变且相等,充入氦气,不影响反应物的浓度,据此分析判断;
(4)N2(g)+3H2(g)![]() 2 NH3(g)的△S<0,△H<0,结合△G=△H-T△S<0分析判断。
2 NH3(g)的△S<0,△H<0,结合△G=△H-T△S<0分析判断。
(1)根据图示,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ的热量,反应的热化学方程式为N2(g)+3H2(g)![]() 2 NH3(g) △H2= -92.4kJmol-1;反应热=正反应的活化能-逆反应的活化能,则正反应的活化能=-92.4kJmol-1+212.4kJ/mol=120 kJmol-1,故答案为:N2(g)+3H2(g)
2 NH3(g) △H2= -92.4kJmol-1;反应热=正反应的活化能-逆反应的活化能,则正反应的活化能=-92.4kJmol-1+212.4kJ/mol=120 kJmol-1,故答案为:N2(g)+3H2(g)![]() 2 NH3(g) △H2= -92.4kJmol-1;120 kJmol-1;
2 NH3(g) △H2= -92.4kJmol-1;120 kJmol-1;
(2)反应体系中加入催化剂,反应速率加快,催化剂能够降低反应的活化能,则E2减小,故答案为:增大;减小;
(3)在甲乙两个体积均为2L固定容积的密闭容器中,分别充入1molN2、3molH2和1molN2、3molH2、1molHe,由于容器的体积不变且相等,充入氦气,不影响反应物的浓度,因此反应速率相等,故答案为:等于;
(4)N2(g)+3H2(g)![]() 2 NH3(g)的△S<0,△H<0,要使得△G=△H-T△S<0,需要在低温下反应才能可以自发,故答案为:小于;低温。
2 NH3(g)的△S<0,△H<0,要使得△G=△H-T△S<0,需要在低温下反应才能可以自发,故答案为:小于;低温。


科目:高中化学 来源: 题型:
【题目】二氧化硫的催化氧化是工业上生产硫酸的主要反应,反应如下:
I:2SO2(g)+O2(g)![]() 2SO3(g) △H1=-197.7kJ·mol-1 K1(浓度平衡常数)
2SO3(g) △H1=-197.7kJ·mol-1 K1(浓度平衡常数)
为研究该反应,某同学设计了以下三种已装固体V2O3催化剂的密闭容器装置

(1)在初始体积与温度相同的条件下,甲、乙、丙中均按2 mol SO2、1molO2投料,达平衡时,三个容器中SO2的转化率从大到小的顺序为___________(用“甲、乙、丙”表示)。
(2)在容器丙中,0.1MPa条件下,在不同温度或不同投料方式下研究上述反应得到数据如下表:

①表中:a=___________;b=___________。
②已知用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算,得到的平衡常数即为压强平衡常数,则Kp1=___________;Kp1___________Kp2(填“>”、“<”或“=”)。
③若按0.4 mol SO2、0.4molO2、0.4 mol SO3进行投料,则反应开始时v正(SO2)_______v逆(SO2)(填“>”、“<”或“=”)。
(3)将上述固体催化剂V2O5换成NO2气体同样可以对该反应起到催化作用,此催化过程如下:
Ⅱ:SO2(g)+NO2(g)![]() SO3(g)+NO(g) △H2 K2(浓度平衡常数)
SO3(g)+NO(g) △H2 K2(浓度平衡常数)
Ⅲ:2NO(g)+O2(g)![]() 2NO2(g) △H3=-114.1kJ·mol-1 K3(浓度平衡常数)
2NO2(g) △H3=-114.1kJ·mol-1 K3(浓度平衡常数)
△H2=___________;K3=___________(用含有K1、K2的表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是( )

A. 该燃料电池持续放电时,正极发生氧化反应,pH变大
B. 放电时,电流从a极经过负载流向b极
C. a极的反应式:N2H4+4OH--4e-===N2↑+4H2O
D. 其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图所示。若上端开口关闭,可得到强还原性的H·(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(羟基自由基)。下列说法错误的是

A. 无论是否鼓入空气,负极的电极反应式均为Fe-2e—===Fe2+
B. 不鼓入空气时,正极的电极反应式为H++e—===H·
C. 鼓入空气时,每生成1mol·OH有2 mol电子发生转移
D. 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
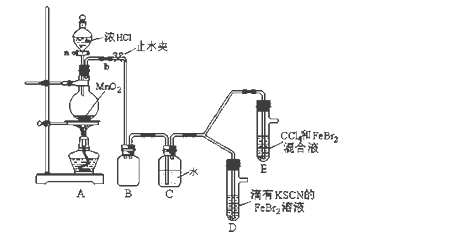
(1)①装置A中发生反应的离子方程式是_____________________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3 是一个可逆反应。
Fe(SCN)3 是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________溶液,若溶液颜色________,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释产生白色沉淀原因__________________、_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 1 L 0. 1 mol·L-1NaC1O溶液中含有的ClO一数目为NA
B. 1 mol Fe在1 mol C12中充分燃烧,转移的电子数目为3 NA
C. 标准状况下22.4 L HF中含有的氟原子数目为NA
D. 常温常压下,32 g O2与O3的混合气体中含有的分子总数小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。

请回答下列问题:
(1)装置F中发生反应的离子方程式是_________________________________________。
(2)装置A的烧瓶中可装试剂_______________________________________________。
(3)B装置的名称是_______________;E装置的作用_____________________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:_______________。
(5)通入C装置的两根导管左边较长、右边较短,目的是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列烷烃的系统名称:
①![]() ______________________________________.
______________________________________.
② _______________________________________ .
_______________________________________ .
③ ___________________________________ .
___________________________________ .
④ ____________ ;
____________ ;
(2)根据下列有机物的名称,写出相应的结构简式:
①2,4二甲基戊烷 ______ .
②2,2,5三甲基3乙基己烷 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醛分子的模型,根据该图和所学化学知识回答下列问题:
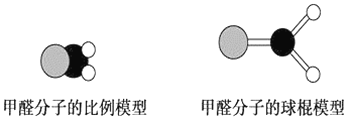
(1)甲醛分子中碳原子的杂化方式是__________,作出该判断的主要理由是__________________________。
(2)下列是对甲醛分子中碳氧键的判断,其中正确的是________(填序号)。
①单键 ②双键 ③σ键 ④π键 ⑤σ键和π键
(3)甲醛分子中C—H键与C—H键间的夹角________(填“=”、“>”或“<”)120°,出现该现象的主要原因是____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com