
����Ŀ��������������Ҫ��Ni������Al��Fe��SiO2�������������ᡢ������ʡ����÷��������Ʊ�NiSO4��7H2O���壬����������ͼ��

��֪��Ksp[Fe(OH)3]=8.0��10��38��Ka sp[Fe(OH)2]=8.0��10��16��K[Al(OH)3]=3.2��10��34��Ksp[Ni(OH)2]=2.0��10��15��1g2=0.3��
�ش���������
��1�����������Ŀ����______��
��2�������ʱ���������ӷ���ʽΪFe+2H+=Fe2++H2����_______��
��3��������������Ҫ�ȼ���H2O2��Һ��������Ӧ�����ӷ���ʽΪ______��Ȼ�����PH=_______ʱ��ʹ��������ǡ����ȫ����(ע������Ũ��С�ڻ����1��10��5mol/Lʱ������ȫ)
��4��������A��______��
��5��Ni2+��ǿ������Һ�л��ɱ�NaClO����ΪNiOOH���÷�Ӧ���ӷ���ʽΪ______��
��6�� NiOOHҲ����Ϊԭ��صĵ缫���ϣ����ڼ����������γ�ȼ�ϵ�أ�����ͨ��N2H4���壬���ĵ缫��ӦʽΪ______��
���𰸡���ȥAl��SiO2 Ni+2H+=Ni2++H2����OH-+H+=H2O H2O2+2Fe2++2H+��2Fe3++2H2O 3.3 ���� 2Ni2++4OH-+ClO-=2NiOOH��+Cl-+H2O N2H4-4e-+4OH-=N2��+4H2O
��������
������������Ҫ��Ni������Al��Fe��SiO2�������������ᡢ������ʣ��Ӽ���ķ�Ӧ��Al2O3+2OH-=2AlO2-+H2O��SiO2+2OH-=SiO32-+H2O�����˺���������Ni��Fe�������������ᡢ������ʣ������õ�Fe2+��Ni2+�����������ǽ�Fe2+ת��ΪFe3+��ͨ��������Һ��pHʹFe3+����Fe��OH��3��������ȥ����ʹNi2+���ɳ������õ���Ni2+����Һ���õ�NiSO4��7H2O���塣
��1����֪����������Ҫ����Ni��Al��Fe��SiO2�����ʱ���ӷ�ӦΪAl+2OH-+2H2O=AlO2-+3H2����SiO2+2OH-=SiO32-+H2O��Ŀ���dz�ȥAl��SiO2����Ϊ����ȥAl��SiO2
��2�����ʱ��Fe��Ni�ᷴӦ������ǰ����ʱ������OH-Ҳ�ᷴӦ����ΪNi+2H+=Ni2++H2����OH-+H+=H2O��
��3��Fe3+���Fe2+������ͨ������pH�������������Լ�˫��ˮĿ��������Fe2+�����ӷ���ʽΪH2O2+2Fe2++2H+��2Fe3++2H2O����Fe3+=1��10��5mol/LʱFe3+����ȫ������![]() ��
��![]() ������H2O2+2Fe2++2H+��2Fe3++2H2O��3.3��
������H2O2+2Fe2++2H+��2Fe3++2H2O��3.3��
��4�����������ǽ�Fe2+ת��ΪFe3+��ͨ��������Һ��pHʹFe3+����Fe��OH��3��������ȥ����ʹNi2+���ɳ��������Բ���A�ǹ�Һ����IJ����������ˣ���Ϊ�����ˣ�
��5��Ni2+ת��ΪNiOOH����Ԫ����+2ת��Ϊ+3�ۣ�NaClO����Ԫ�ؽ�������Cl-�����ӷ���ʽΪ��2Ni2++4OH-+ClO-=2NiOOH��+Cl-+H2O����Ϊ��2Ni2++4OH-+ClO-=2NiOOH��+Cl-+H2O��
��6�����£�N2H4��ȼ�ϵ���У�ͨ��ȼ������N2H4Ϊ�������ڼ��Ե������ʧȥ�������ɵ�����ˮ���缫��ӦΪN2H4-4e-+4OH-=N2��+4H2O���ʴ�Ϊ��N2H4-4e-+4OH-=N2��+4H2O��


 ��ʦ����ָ���ο�ʱϵ�д�
��ʦ����ָ���ο�ʱϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������г���MnS����������ȥ��ҵ��ˮ�е�Cu2+��Cu2+��aq��+MnS��s��CuS��s��+Mn2+��aq��������˵��������� ��������
A. MnS��![]() ��CuS��
��CuS��![]() ��
��
B. �÷�Ӧ�ﵽƽ��ʱ��![]()
C. ��ƽ����ϵ�м�������![]() �����
�����![]() ���
���
D. ![]() ����Һ�м�������������
����Һ�м�������������![]() �����
�����![]() ���
���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ�ڹ�ҵ����Ҫ�������쵼�ߡ�����Ԫ���ȣ�ͭ���γɣ�1�ۺͣ�2�۵Ļ����
(1)д����̬Cu���ĺ�������Ų�ʽ___________________________________��
(2)��ͼ��ͭ��ij��������ľ���ʾ��ͼ����������Ļ�ѧʽΪ________��

(3)������ͭ��Һ�еμӰ�ˮ��������ɫ�������ٵμӰ�ˮ�������պ�ȫ���ܽ�ɵõ�����ɫ��Һ�����������м��뼫�Խ�С���Ҵ�������������ɫ��[Cu(NH3)4]SO4��H2O�������������е�NH3ͨ��________������������Cu2����ϣ�NH3������Nԭ�ӵ��ӻ���ʽ��____����NH3���ӻ�Ϊ�ȵ������һ������________��
(4)CuO���۵��CuCl���۵�____(��ߡ��͡�)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ըߴ�H2Ϊȼ�ϵ����ӽ���Ĥȼ�ϵ�ؾ�������Ч�ʸߡ�����Ⱦ���ŵ㣬��ȼ����������CO���������̵��������
(1)�Լ״�Ϊԭ����ȡ�ߴ�H2����Ҫ�о����״�ˮ��������������Ҫ��������������Ӧ��
����Ӧ��CH3OH(g) + H2O(g) ==CO2(g) + 3H2(g) ��H = +49 kJmol��1
����Ӧ��H2(g) + CO2(g) ==CO(g) + H2O(g) ��H=+41 kJmol��1
�ټ״������ڴ����������ѽ�ɵõ�H2��CO����÷�Ӧ���Ȼ�ѧ����ʽΪ_________________�����ܼӿ췴Ӧ�����������CH3OHƽ��ת���ʵ�һ�ִ�ʩ��_________________��
�ڷ����ʵ�����ˮ����![]() �Լ״�ˮ������������ĺô���_______________��
�Լ״�ˮ������������ĺô���_______________��
��ij�¶��£���n(H2O)��n(CH3OH) = 1��1��ԭ������������ܱ������У���ʼѹǿΪP1����Ӧ��ƽ��ʱ��ѹǿΪP2����ƽ��ʱ�״���ת����Ϊ____________�����Ը���Ӧ����
(2)��ҵ����CH4��ˮ������һ����������ȡH2��ԭ��Ϊ��CH4(g) + H2O(g)=CO(g) + 3H2(g) ��H = + 203 kJmol��1
�ٸ÷�Ӧ�淴Ӧ���ʱ���ʽΪ��v��=kc(CO) c3(H2)��k Ϊ���ʳ�������ij�¶��²��ʵ�����������
COŨ��(molL��1) | H2Ũ��(molL��1) | �淴Ӧ����(molL��1min��1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.15 | 8.1 |
���������ݿɵø��¶��£��÷�Ӧ���淴Ӧ���ʳ��� kΪ_________L3mol��3min��1��

�������Ϊ3 L���ܱ�������ͨ�����ʵ�����Ϊ3 mol��CH4��ˮ��������һ�������·���������Ӧ�����ƽ��ʱH2������������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ��ʾ����ѹǿPl_______P2����������������С��������N��v��_______M��v������������������С����������Q���Ӧ�¶��¸÷�Ӧ��ƽ�ⳣ��K=________��ƽ������������м���1 mol CH4��1 mol CO��ƽ��_______�ƶ�����������Ӧ�����������淴Ӧ������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǻ���������ũҩ��ҩ����Ϻϳɵ���Ҫ�м��壬�����ɱ��Ӻ���ȩ����һ�������·�Ӧ�Ƶã�

����˵������ȷ����
A. ������Ӧ��ԭ�������ʿɴﵽ100%
B. �ں˴Ź��������ж��ǻ�������Ӧ����6�����շ�
C. 1mol���ǻ�������������NaOH��Һ��Ӧ������3 mol NaOH
D. ������FeCl3��Һ������ȩ��ͱ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��2-��������������Ϳ����������Ӽ���������������ɫҺ�壬�ܶ� 2.18 g��cm-3���е�131.4�棬�۵�9.79�棬������ˮ�������ڴ����ѡ���ͪ���л��ܼ�����ʵ�����п�������ͼ��ʾװ���Ʊ�1��2-�������顣���з�Һ©������ƿa��װ���Ҵ���Ũ����Ļ��Һ���Թ�d��װ��Һ��(���渲������ˮ)����д���пհף�
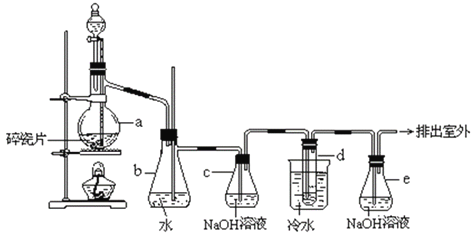
(1) д�����������Ҵ��Ʊ�1��2-���������������ѧ��Ӧ����ʽ��
��____________________________________________����Ӧ����Ϊ________________��
��____________________________________________����Ӧ����Ϊ________________��
(2)װ��b���Գ䵱��ȫƿ����ֹ���������磺��װ��a��b�Ϸ�����ѹǿ��С����װ��b�е�����Ϊ________________________________________________________________��
(3)����c��NaOH��Һ�������ǣ�________________________________������cװ�ã���d�з�������Ӧ�����ӷ���ʽΪ________________________________________��
(4)������ʵ��ʱ��Ӧʹaװ���е�Һ���¶�Ѹ�����ߵ������¶ȣ����û�ѧ����ʽ��ʾ��ԭ��_____________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��������ؾ����������ṹ�����������Ļ��ϼ۲���Ϊ0�ۣ�����Ϊ��2�ۣ���ͼΪ�������ؾ����һ����������������С���ظ���Ԫ����������˵����ȷ���ǣ�������

A. �������صĻ�ѧʽΪKO2��ÿ��������14��K+��13��O2��
B. ������ÿ��K+��Χ��8��O2����ÿ��O2����Χ��8��K+
C. ��������ÿ��K+���������K+��8��
D. �����У�0����ԭ���멁2����ԭ�ӵ���Ŀ��Ϊ3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������VA��Ԫ���γɵĻ���������Ҫ�İ뵼����ϣ�Ӧ����㷺�����黯��(GaAs)���ش��������⣺
(1)��̬Gaԭ�ӵĺ�������Ų�ʽΪ_____����̬Asԭ�Ӻ�����_________��δ�ɶԵ��ӡ�
(2)��ʧȥ���ӵ�������(��λ��kJ��mol-1)����ֵ����Ϊ577��1984.5��2961.8��6192�ɴ˿���֪�ص���Ҫ���ϼ�Ϊ____��+3����ĵ縺�Ա���____(������������С��)��
(3)�Ƚ������ص�±������۵�ͷе㣬������仯���ɼ�ԭ��________________________��
�ص�±���� | GaCl3 | GaBr3 | GaI3 |
�۵�/�� | 77.75 | 122.3 | 211.5 |
�е�/�� | 201.2 | 279 | 346 |
GaF3���۵㳬��1000 �棬���ܵ�ԭ��___________________________________________��
(4)��ˮ�ϲ����صĽṹ��ͼ��ʾ��������ԭ�ӵ���λ��Ϊ______���������̼ԭ�ӵ��ӻ���ʽΪ______________��

(5)�黯���۵�Ϊ1238�棬���������ṹ��ͼ��ʾ����������Ϊa=565 pm���þ��������Ϊ_________��������ܶ�Ϊ___________(��NAΪ�����ӵ���������ֵ,�г���ʽ����)g��cm-3��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ�����ʾ��ȷ����
A. ����������������Ϊ6��̼ԭ�ӣ�![]() B. �����ӵĽṹʾ��ͼ��
B. �����ӵĽṹʾ��ͼ��![]()
C. �������Ƶĵ���ʽ��![]() D. ��ϩ�Ľṹ��ʽ��CH2CH2
D. ��ϩ�Ľṹ��ʽ��CH2CH2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com