
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是( )

A. 用图甲所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体
B. 按装置乙所示的气流方向可用于收集H2、NO等
C. 用图丙所示装置,分离CCl4萃取碘水后的有机层和水层
D. 用图丁所示装置,可以证明氧化性:Cl2>Br2>I2
【答案】C
【解析】
A、直接蒸干AlCl3饱和溶液,氯化氢挥发,导致水解平衡右移;
B、H2密度比空气小,NO易与空气中氧气反应;
C、CCl4的密度比水大;
D、Cl2能和NaBr、KI发生置换反应生成Br2、I2。
A项、AlCl3为强酸弱碱盐,在溶液中发生水解生成氢氧化铝胶体和氯化氢,直接蒸干AlCl3饱和溶液,氯化氢挥发,导致水解平衡右移,使水解趋于完全生成氢氧化铝沉淀,不能得到无水AlCl3,故A错误;
B项、H2密度比空气小,应用向下排空法收集,气体应短进长出,NO易与空气中氧气反应,不能用排空气法收集,故B错误;
C项、CCl4的密度比水大,分离CCl4萃取碘水后的有机层在下层,水层在上层,与图中装置分层现象相符,故C正确;
D项、通入的Cl2能和NaBr、KI发生置换反应生成Br2、I2,无法确认Br2是否和KI反应,所以不能比较Br2和I2的非金属性强弱,故D错误。
故选C。


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为____________;Al与NaOH溶液反应的离子方程式为____________。
(2)30Si的原子的中子数为________________________。SiO2的晶体类型为_____________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是___________________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是____________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钾可用于有机合成、制药等,它是一种白色立方结晶或粉末,易溶于水。实验室制备KI 的实验装置如下

实验步骤如下:
①在上图所示的C中加入 127g 研细的单质I2 和 195g 30%的 KOH 溶液,剧烈搅拌。
②I2完全反应后,打开弹簧夹向其中通入足量的 H2S。
③将装置 C 中所得溶液用稀 H2SO4酸化后,置于水浴上加热 10min。
④在装置 C 的溶液中加入 BaCO3 ,充分搅拌后,过滤、洗涤。
⑤将滤液用氢碘酸酸化,蒸发浓缩至表面出现结晶膜, 、 、洗涤、干燥。
⑥得产品 145g。
回答下列问题;
(1)步骤①将碘研细的目的是_____________________________________。
(2)装置A 中发生反应的离子方程式为_______________________________ ;装置 B 中的试剂是____________________,C装置的名称是_____________。
(3)装置 C 中I2与 KOH 反应产物之一是 KIO3 ,该反应的化学方程式为_______________。
(4)步骤④的目的是___________________________________ 。
(5)补充完整步骤⑤ __________________、_______________。
(6)本次实验产率为__________________ (保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(11分)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为________,该元素的符号是________。
(2)Y元素原子的价层电子的电子排布图为________,该元素的名称是________。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________。
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___________________________________________________________。
(5)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由
_________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是重要的化工原料,也是清洁的能源。
Ⅰ、工业上,在一定条件下用乙烯水化法制备乙醇。已知热化学方程式如下:
①CH2=CH2(g)+H2O(g)CH3CH2OH(g) ΔH1
②2CH2=CH2(g)+H2O(g)CH3CH2OCH2CH3(g) ΔH2
③2CH3CH2OH(g)CH3CH2OCH2CH3(g)+H2O(g) ΔH3
(1)几种化学键的键能如下:
化学键 | H-C | C=C | H-O | C-O | C-C |
键能kJ·mol-1 | 413 | 615 | 463 | 351 | 348 |
根据键能计算ΔH1=________________kJ·mol-1。
(2)在恒容密闭容器中发生反应②,下列能说明该反应达到平衡的是_________。
a、容器中总压强保持不变
b、H2O(g)的消耗速率与CH3CH2OCH2CH3(g)生成速率相等
c、气体平均摩尔质量保持不变
d、容器中气体密度保持不变
(3)在密闭容器中投入CH2=CH2(g)、H2O(g)和催化剂发生反应①,乙烯的平衡转化率与温度、压强的关系如图所示。

①x代表________________。(选填“温度”或“压强”)
②L1和L2哪个大?并请说出理由:_____________________________________________________。
Ⅱ、如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和lmolHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:

(4)达到平衡时,隔板K最终停留在0刻度左侧某一处,记为a处,则a的取值范围是__________。
(5)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,则该反应化学平衡常数为_______________。
(6)若一开始就将K、F如上图固定,其他条件均不变,则达到平衡时:测得甲中A的转化率为b,则乙中C的转化率为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5,依次发生分解反应:①N2O5(g)![]() N2O3(g)+O2(g)、②N2O3(g)
N2O3(g)+O2(g)、②N2O3(g)![]() N2O(g)+O2(g)。在体积为2 L的恒容密闭容器中充入8 mol N2O5,加热到T ℃时反应达到平衡状态,此时O2和N2O3的物质的量分别为9 mol、3.4 mol,则T ℃时反应①的平衡常数为
N2O(g)+O2(g)。在体积为2 L的恒容密闭容器中充入8 mol N2O5,加热到T ℃时反应达到平衡状态,此时O2和N2O3的物质的量分别为9 mol、3.4 mol,则T ℃时反应①的平衡常数为
A. 10.7 B. 8.5 C. 9.6 D. 10.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度时,在2 L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。由此分析,该反应的化学方程_____________________________________;从反应开始至2 min,Z的反应速率为_____ mol·L-1·min-1。

(2)若上述反应的△H<0,下列有关该反应速率的叙述,正确的是_________。
A.升高温度和增大压强均可以增大活化分子百分数,加快反应速率
B.使用催化剂可以使反应的活化能降低,加快反应速率
C.活化分子间所发生的碰撞为有效碰撞
D.降低温度,v正、v逆均减小且v正减小的倍数小于v逆减小的倍数
(3)在一密闭容器中发生反应N2(g)+3H2(g)![]() 2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。 t1、t3、t4时刻分别改变的一个条件是:
2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。 t1、t3、t4时刻分别改变的一个条件是:
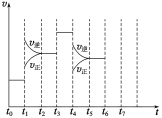
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氦气
t1时刻________;t3时刻________;t4时刻________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 糖类都是天然高分子化合物,组成与结构比较复杂
B. 可以用酸性高錳酸鉀溶液鉴别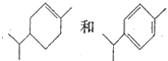
C. 体积分数为90%的乙醇溶液能使蛋白质变性,常用于医疗消毒
D. 甲苯的一溴代物和2一甲基丁烷的一溴代物都有4种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为_____ (填放热,吸热,无法确定 )反应。
②下列措施能用勒夏特列原理解释是_____(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式_____。
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=_____(用ab表示)。
(4)原料气H2可通过反应 CH4(g)+H2O (g)![]() CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:

①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__(填“增大”,“减小”减小,“不变”不变)。
(5)原料气H2还可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08molL﹣1,该温度下反应的平衡常数K值为_____。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com