
【题目】下列关于有机化合物的说法正确的是
A. 糖类都是天然高分子化合物,组成与结构比较复杂
B. 可以用酸性高錳酸鉀溶液鉴别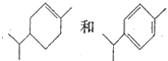
C. 体积分数为90%的乙醇溶液能使蛋白质变性,常用于医疗消毒
D. 甲苯的一溴代物和2一甲基丁烷的一溴代物都有4种(不考虑立体异构)
【答案】D
【解析】
A、相对分子质量在一万以上的才是高分子化合物;
B、与苯环相连的侧链上第一碳上有氢就能使酸性高錳酸鉀溶液褪色;
C、用于医疗消毒的酒精体积分数为75%;
D、甲苯苯环上有三种氢,甲基上有1种氢,一溴代物有4种,2一甲基丁烷有1、2、3、4号碳上四种氢,一溴代物有4种;
A、相对分子质量在一万以上的才是高分子化合物,而单糖、二糖均不是高分子化合物,故A错误;
B、与苯环相连的侧链上第一碳上有氢就能使酸性高錳酸鉀溶液褪色,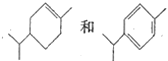 均能使酸性高錳酸鉀溶液褪色,故B错误;
均能使酸性高錳酸鉀溶液褪色,故B错误;
C、 体积分数为75%的乙醇溶液能使蛋白质变性,常用于医疗消毒,故C错误;
D、甲苯苯环上有三种氢,甲基上有1种氢,一溴代物有4种,2一甲基丁烷有1、2、3、4号碳上四种氢,一溴代物有4种,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2SO4溶液、K2CO3溶液、盐酸
(1)操作①的名称是____________,操作②的名称是_____________。
(2)试剂a是____________,固体B是___________。(填化学式)
(3)加入试剂b所发生的化学反应方程式为:______________________________________。
(4)该方案能否达到实验目的:________。若不能,应如何改进(若能,此问不用回答)_________。
(5)若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是_________的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要分离下列四组混合物
①饱和食盐水与沙子 ②从KNO3和NaCl的混合溶液中获得KNO3
③水和汽油的混合物 ④CCl4液体与甲苯液体的混合物
(已知CCl4与甲苯互溶,沸点分别为76.75℃和110.6 ℃)
(1)分离①、②的操作分别为________、________。
(2)分离③时所使用仪器中有一种在其他组分分离时无需使用,这种仪器是________。
(3)上述四组分离时需使用酒精灯的有________和________(填序号)。
(4)为除去粗盐中的MgCl2、CaCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
①第Ⅰ步操作的名称是____________。
②若第Ⅱ、Ⅳ步顺序颠倒,是否会对实验结果产生影响?________(填“有影响”或“无影响”)。
③第Ⅴ步操作所需玻璃仪器的名称是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
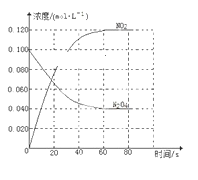
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH________(填“大于”或“小于”)0;100 ℃时,体系中各物质浓度随时间变化如下图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
a.T________(填“大于”或“小于”)100 ℃,判断理由是________________________________。
b.温度T时反应的平衡常数K2=____________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为更有效处理工业废气中排放的氮氧化物(NOx)、SO2等,减少大气污染。科学家不断对相关反应进行研究尝试。
(1)脱硝反应机理如图,Cu+的作用是____________,C2H4参与的反应方程式 ______________ 。
(2) 选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,其反应原理主要为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g);ΔH= -1627 kJmol-1
4N2(g)+6H2O(g);ΔH= -1627 kJmol-1
① 其中被NO和O2氧化的NH3的比例 ________ 。
②该方法应控制反应温度在315~400℃之间,反应温度不宜过高的原因是________ 。
③ 氨氮比 n(NH3)/n(NO) 会直接影响该方法的脱硝率。如图为350 ℃时,只改变氨气的投放量,NO的百分含量与氨氮比的关系图。当 n(NH3)/n(NO) >1.0时,烟气中NO含量反而增大,主要原因是_________________________________。

(3) 烟气脱硫、脱硝一体化技术是大气污染防治研究的热点。ClO2及NaClO2均是性能优良的脱硫脱硝试剂。
① ClO2在酸性条件下稳定,在NaOH溶液中可歧化为NaClO3和NaClO2,该反应的化学方程式为____。

② 某研究小组用ClO2进行单独脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图所示。当3<pH<7时,随pH的增大,SO2脱除率逐渐降低,其原因是________;在pH约7.8之后,随pH的增大,SO2脱除率又开始升高,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常温下向20.0 mL的盐酸中,逐滴加入0.10 mol·L-1 NaOH溶液时,溶液的pH随 NaOH溶液的体积V(mL)变化的曲线,根据图像所得的下列结论中正确的是

A. 原盐酸的浓度为0.10 mol·L-1
B. x的值为2.0
C. 当pH=12时,V值为20.4
D. 原盐酸的浓度为1.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的转化系统原理示意图。下列说法正确的是

A. 好氧微生物反应器中反应为:NH4++2O2==NO3-+2H++H2O
B. B极电势比A极电势低
C. A极的电极反应式CH3COO-+8e-+2H2O==2CO2+7H+
D. 当电路中通过1mol电子时,理论上总共生成2.24LN2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如下图所示,图中含酚废水中有机物可用C6H6O表示,左、中、右室间分别以离子交换膜分隔。下列说法不正确的是( )

A. 左池的pH值降低
B. 右边为阴离子交换膜
C. 右池电极的反应式:2NO3-+10e-+12H+= N2↑+ 6H2O
D. 当消耗0.1molC6H6O,在标准状况下将产生0.28mol氮气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com