
【题目】微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的转化系统原理示意图。下列说法正确的是

A. 好氧微生物反应器中反应为:NH4++2O2==NO3-+2H++H2O
B. B极电势比A极电势低
C. A极的电极反应式CH3COO-+8e-+2H2O==2CO2+7H+
D. 当电路中通过1mol电子时,理论上总共生成2.24LN2
【答案】A
【解析】
图示分析可知微生物燃料电池中氢离子移向B电极,说明A为原电池的负极,B为原电池的正极,NO3-离子在正极得到电子生成氮气发生还原反应,CH3COO-在原电池负极失电子生成二氧化碳气体,发生氧化反应,环境为酸性介质;则A极的电极反应式为:CH3COO--8e-+2H2O═2CO2+7H+,B电极反应式为:2NO3-+12H++10e-═N2+6H2O。
A、NH4+在好氧微生物反应器中转化为NO3-,NH4++2O2═NO3-+2H++H2O,故A正确;
B、图示分析可知微生物燃料电池中氢离子移向B电极,说明A为原电池的负极,B为原电池的正极, B极电势比A极电势高,故B错误;
C、A极的电极反应式为:CH3COO--8e-+2H2O═2CO2+7H+,故C错误;
D、当电路中通过1mol电子时,理论上总共生成标准状况下的2.24LN2,故D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究。
(1)气体产物成分的探究。小组成员采用如下装置(可重复选用)进行实验:

①装置D的名称为___________。
②按照气流从左到右的方向,上述装置的连接顺序为___________→尾气处理装置(填仪器接口的字母编号)。
③实验前先通入一段时间N2,其目的为______________________。
④实验证明了气体产物中含有CO,依据的实验现象为______________________。
(2)固体产物成分的探究。充分反应后,A处反应管中残留黑色固体。查阅资料可知,黑色固体可能为Fe或FeO。小组成员设计实验证明了其成分只有FeO,其操作及现象为___________。
(3)依据(1)和(2)结论,可知A处反应管中发生反应的化学方程式为___________。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取m g草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液。
步骤2:取上述溶液25.00mL,用c mol· L -1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤3中加入锌粉的目的为____________________________________________。
(5)草酸亚铁晶体样品的纯度为____________________________________________;若步骤1配制溶液时部分Fe2+被氧化,则测定结果将___________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成单质和化合物最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)C原子的价电子轨道表达式为______________________。
(2)碳元素是组成有机物必不可少的元素。1828年,化学家维勒首次用加热的方法将无机物氰酸铵[NH4(OCN)]转化为有机物尿素,开启了人造有机物的大门。氰酸铵中阳离子的立体构型是___________。有机物M( )在一定条件下生成N(
)在一定条件下生成N( )
)
①沸点:M___________N(填“大于”或“小于”)。
②M中碳原子的杂化类型为___________,不同杂化类型的碳原子数之比为___________。
(3)碳的有机物常作为金属有机化合物的配体,如EDTA(乙二胺四乙酸)。EDTA与Ca2+形成的配离子如图所示。该配离子的配位数是___________,配体中碳原子的杂化方式有_________。
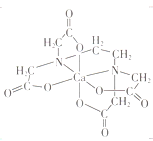
(4)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图所示,图中用实线标出了石墨的一个六方晶胞。

①石墨中C原子上未参与杂化的所有p轨道相互平行且重叠,使p轨道中的电子可在整个碳原子平面中运动而导电。六方氮化硼(BN)与石墨晶体结构类似,硼原子和氮原子交替相连,而六方BN却无法导电,其原因是___________。
②晶胞有两个基本要素:石墨一种晶胞结构和部分晶胞参数如图。

a.原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为A(0,0,0)、B(0,1,![]() ),则C原子的坐标参数为___________。
),则C原子的坐标参数为___________。
b. 晶胞参数用以描述晶胞的大小和形状。已知石墨晶胞底边长为acm,层间距为 d cm,阿伏加德罗常数的值为NA,则石墨的密度为___________g·cm-3(写出表达式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 糖类都是天然高分子化合物,组成与结构比较复杂
B. 可以用酸性高錳酸鉀溶液鉴别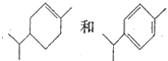
C. 体积分数为90%的乙醇溶液能使蛋白质变性,常用于医疗消毒
D. 甲苯的一溴代物和2一甲基丁烷的一溴代物都有4种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用有机原料A制备 和聚乙酸乙烯酯,其流程为:
和聚乙酸乙烯酯,其流程为:

已知:①![]() ②
②![]()
请回答下列问题:
(1)A→B的反应类型是___________,J中官能团的名称为___________。
(2)反应②的试剂和条件分别是___________,G的结构简式是___________。
(3)写出反应①的化学方程式:_________________________________。
(4)与A具有相同官能团且只有一个甲基的芳香化合物的同分异构体有多种,写出其中一种核磁共振氢谱为五组峰且能发生银镜反应的结构简式为______________________。
(5)参照下述示例合成路线,设计一条由乙二醇为起始原料制备聚乙二酸乙二醋的合成路线。示例:![]() _______________
_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下各组列物质反应的化学方程式并指出反应类型:
(1)硫酸和Ba(OH)2溶液_____________、______________ ;
(2)盐酸和Na2CO3溶液____________、______________;
(3)H2O2溶液和MnO2混合_________、_________________;
(4)铝和氯化铜溶液__________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1 mol/L的HClO2和1 mol/L的HMnO4两种酸溶液,起始时的体积均为V0,分别向两溶液中加水稀释至体积为V,所得曲线如图所示。下列说法正确的是

A. 当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
B. 在0≤pH≤5时,HMnO4溶液满足:pH=lg(V/V0)
C. 常温下,浓度均为0.1mol·L-1的NaClO2和NaMnO4溶液的pH:NaMnO4>NaClO2
D. 稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种易水解、受热易分解的白色固体,某研究小组用下图所示的实验装置制备氨基甲酸铵,反应原理为:2NH3(g)+CO2(g)=H2NCOONH4(s) △H<0。

(1)仪器B的名称是________________。
(2)打开阀门K,装置E中由固体药品所产生的气体就立即进入装置D,则该固体药品的名称为________________。
(3)装置D为制备氨基甲酸铵的反应器(CCl4充当惰性介质),在合适催化剂下搅拌一段时间。
①反应在冰水浴中进行的原因为_______________________________________。
②当CCl4液体中产生较多晶体悬浮物时,即停止反应,__________(填操作名称)分离得到粗产品。
(4)仪器G的作用有:_______________________________________。
(5)该实验装置中有一处不足,改进方法是______________________________________。
(6)已知氨基甲酸铵可完全水解为碳酸氢铵,则该反应的化学方程式_________________。
(7)为测定某样品中氨基甲酸铵的质量分数,某研究小组用该样品进行实验,已知杂质不参与反应,请补充完整测定某样品中氨基甲酸铵质量分数的实验方案(限选试剂:蒸馏水、澄清石灰水、Ba(OH)2溶液):用天平称取一定质量的样品,加水溶解,____________________,测量的数据取平均值进行计算。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com