
【题目】碳是形成单质和化合物最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)C原子的价电子轨道表达式为______________________。
(2)碳元素是组成有机物必不可少的元素。1828年,化学家维勒首次用加热的方法将无机物氰酸铵[NH4(OCN)]转化为有机物尿素,开启了人造有机物的大门。氰酸铵中阳离子的立体构型是___________。有机物M( )在一定条件下生成N(
)在一定条件下生成N( )
)
①沸点:M___________N(填“大于”或“小于”)。
②M中碳原子的杂化类型为___________,不同杂化类型的碳原子数之比为___________。
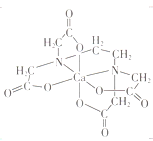
(3)碳的有机物常作为金属有机化合物的配体,如EDTA(乙二胺四乙酸)。EDTA与Ca2+形成的配离子如图所示。该配离子的配位数是___________,配体中碳原子的杂化方式有_________。
(4)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图所示,图中用实线标出了石墨的一个六方晶胞。

①石墨中C原子上未参与杂化的所有p轨道相互平行且重叠,使p轨道中的电子可在整个碳原子平面中运动而导电。六方氮化硼(BN)与石墨晶体结构类似,硼原子和氮原子交替相连,而六方BN却无法导电,其原因是___________。
②晶胞有两个基本要素:石墨一种晶胞结构和部分晶胞参数如图。

a.原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为A(0,0,0)、B(0,1,![]() ),则C原子的坐标参数为___________。
),则C原子的坐标参数为___________。
b. 晶胞参数用以描述晶胞的大小和形状。已知石墨晶胞底边长为acm,层间距为 d cm,阿伏加德罗常数的值为NA,则石墨的密度为___________g·cm-3(写出表达式即可)
【答案】![]() 正四面体 小于 sp2、sp3杂化 7︰2 6 sp2和sp3杂化 氮的电负性较大,相互平行且重叠p轨道(或大兀键)上的电子在很大程度上被定域在氮的周围,不能自由流动
正四面体 小于 sp2、sp3杂化 7︰2 6 sp2和sp3杂化 氮的电负性较大,相互平行且重叠p轨道(或大兀键)上的电子在很大程度上被定域在氮的周围,不能自由流动 ![]()
![]()
【解析】
(1)碳原子价电子排布式为2s22p2;
(2) 氰酸铵中阳离子为NH4+离子;
①对结构相似的有机物,其分子量越大沸点就越高;
②M中含有C-C、苯环以及C=O;
(3)由图可知,EDTA与Ca2+形成的配离子中为Ca2+中心离子,EDTA中N、O原子与Ca2+之间形成配位键;EDTA中含有饱和碳原子和—COO—;
(4)①由于N和B的电负性相差较大;
②a.由B点坐标可得,a=1,d=1/2,所以C点坐标为(1,1,1/2);
b. 由石墨的晶胞结构得晶胞中C原子的数量为1+2×1/2+8×1/8+4×1/4=4,晶胞体积为2d×a×a×sin60°=![]() 。
。
(1)碳原子价电子排布式为2s22p2,根据能量最低原理、泡利不相容原理和洪特规则,其价电子原子轨道表示式为![]() ,故答案为:
,故答案为:![]() ;
;
(2) 氰酸铵中阳离子为NH4+离子,NH4+离子中N原子价层电子对数为4,孤对电子数为0,故空间构型为正四面体形,故答案为:正四面体;
①对结构相似的有机物,其分子量越大沸点就越高,所以沸点M小于N,故答案为:小于;
②因为M中含有C-C、苯环以及—COO—,所以M中C原子的杂化方式为sp2、sp3杂化,两种杂化方式的碳原子比例为:(6+1):2=7:2,故答案为:sp2和sp3杂化;7:2;
(3)由图可知,EDTA与Ca2+形成的配离子中为Ca2+中心离子,EDTA中N、O原子与Ca2+之间形成配位键,Ca2+的配位数为6;EDTA中含有饱和碳原子和—COO—,故C原子的杂化方式为sp2、sp3杂化,故答案为:6;sp2和sp3杂化;
(4)①由于N和B的电负性相差较大,在六方氮化硼晶体中相互平行且重叠p轨道(或大兀键)上的电子在很大程度上被定域在N原子的周围,不能自由流动,故不能导电,故答案为:氮的电负性较大,相互平行且重叠p轨道(或大兀键)上的电子在很大程度上被定域在氮的周围,不能自由流动;
②a.由B点坐标可得,a=1,d=1/2,所以C点坐标为(1,1,1/2),故答案为:(1,1,1/2);
b. 由石墨的晶胞结构得晶胞中C原子的数量为1+2×1/2+8×1/8+4×1/4=4,晶胞体积为2d×a×a×sin60°=![]() ,则石墨的密度为
,则石墨的密度为![]() ,故答案为:
,故答案为:![]() 。
。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,分别向NaA溶液和MCl溶液中加入盐酸和NaOH溶液,混合溶液的pH与离子浓度变化关系如下图所示。下列说法不正确的是

A. 曲线L1表示![]() 与pH的变化关系
与pH的变化关系
B. Ka(HA)=1×10-5.5
C. a点时两溶液中水的电离程度相同
D. 0.01mol·L-1MA溶液中存在:c(M+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室用50 mL 0.50mol/L盐酸、50mL 0.55 mol/LNaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:

实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
(1)图中实验装置中尚缺少的玻璃仪器是____________________________.
(2)在操作正确的前提下,提高中和热测定准确性的关键是________________________.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=_________[盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g·℃)计算].
(4)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将_____(填“偏大”、“偏小”、“不变”).如改用60 mL0.5moI/L的盐酸与50 mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”或“不相等”),所求中和热_____(填“相等”或“不相等”)。
(5) 上述实验结果数值与57.3相比有偏差,产生偏差的原因可能是(填字母)______.
A.测量盐酸的温度后,温度计没有用水冲洗干净
B. 把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取NaOH溶液时仰视计数
E.大烧杯的盖扳中间小孔太大。
Ⅱ.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过褪色所需时间来判断反应的快慢。该小组设计了如下方案:

(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4) ≥_______。
(2)试验编号②和③探究的内容是_____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=__________mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要分离下列四组混合物
①饱和食盐水与沙子 ②从KNO3和NaCl的混合溶液中获得KNO3
③水和汽油的混合物 ④CCl4液体与甲苯液体的混合物
(已知CCl4与甲苯互溶,沸点分别为76.75℃和110.6 ℃)
(1)分离①、②的操作分别为________、________。
(2)分离③时所使用仪器中有一种在其他组分分离时无需使用,这种仪器是________。
(3)上述四组分离时需使用酒精灯的有________和________(填序号)。
(4)为除去粗盐中的MgCl2、CaCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
①第Ⅰ步操作的名称是____________。
②若第Ⅱ、Ⅳ步顺序颠倒,是否会对实验结果产生影响?________(填“有影响”或“无影响”)。
③第Ⅴ步操作所需玻璃仪器的名称是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 增加反应物的物质的量,反应速率不一定能加快
B. 可逆反应A(g)![]() B(g)+C(g),增大压强,正反应速率和逆反应速率都增大
B(g)+C(g),增大压强,正反应速率和逆反应速率都增大
C. 对达到平衡的一个放热的可逆反应,若降低温度正反应速率减小,逆反应速率增大
D. 参加反应物质的性质是决定化学反应速率的主要因素
查看答案和解析>>
科目:高中化学 来源: 题型:
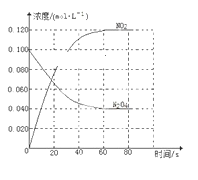
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH________(填“大于”或“小于”)0;100 ℃时,体系中各物质浓度随时间变化如下图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
a.T________(填“大于”或“小于”)100 ℃,判断理由是________________________________。
b.温度T时反应的平衡常数K2=____________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为更有效处理工业废气中排放的氮氧化物(NOx)、SO2等,减少大气污染。科学家不断对相关反应进行研究尝试。
(1)脱硝反应机理如图,Cu+的作用是____________,C2H4参与的反应方程式 ______________ 。
(2) 选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,其反应原理主要为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g);ΔH= -1627 kJmol-1
4N2(g)+6H2O(g);ΔH= -1627 kJmol-1
① 其中被NO和O2氧化的NH3的比例 ________ 。
②该方法应控制反应温度在315~400℃之间,反应温度不宜过高的原因是________ 。
③ 氨氮比 n(NH3)/n(NO) 会直接影响该方法的脱硝率。如图为350 ℃时,只改变氨气的投放量,NO的百分含量与氨氮比的关系图。当 n(NH3)/n(NO) >1.0时,烟气中NO含量反而增大,主要原因是_________________________________。

(3) 烟气脱硫、脱硝一体化技术是大气污染防治研究的热点。ClO2及NaClO2均是性能优良的脱硫脱硝试剂。
① ClO2在酸性条件下稳定,在NaOH溶液中可歧化为NaClO3和NaClO2,该反应的化学方程式为____。

② 某研究小组用ClO2进行单独脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图所示。当3<pH<7时,随pH的增大,SO2脱除率逐渐降低,其原因是________;在pH约7.8之后,随pH的增大,SO2脱除率又开始升高,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的转化系统原理示意图。下列说法正确的是

A. 好氧微生物反应器中反应为:NH4++2O2==NO3-+2H++H2O
B. B极电势比A极电势低
C. A极的电极反应式CH3COO-+8e-+2H2O==2CO2+7H+
D. 当电路中通过1mol电子时,理论上总共生成2.24LN2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法中错误的是( )
A. 4.6g金属钠变成Na+,失去的电子数为0.2NA
B. 1.0L1mol/LNaAlO2水溶液中含有的氧原子数为2NA
C. 17gNH3所含的电子数为10NA
D. 9.5gMgCl2溶于水所得溶液中含Cl-数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com