
【题目】设NA为阿伏加德罗常数的数值,下列说法中错误的是( )
A. 4.6g金属钠变成Na+,失去的电子数为0.2NA
B. 1.0L1mol/LNaAlO2水溶液中含有的氧原子数为2NA
C. 17gNH3所含的电子数为10NA
D. 9.5gMgCl2溶于水所得溶液中含Cl-数为0.2NA
 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】碳是形成单质和化合物最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)C原子的价电子轨道表达式为______________________。
(2)碳元素是组成有机物必不可少的元素。1828年,化学家维勒首次用加热的方法将无机物氰酸铵[NH4(OCN)]转化为有机物尿素,开启了人造有机物的大门。氰酸铵中阳离子的立体构型是___________。有机物M( )在一定条件下生成N(
)在一定条件下生成N( )
)
①沸点:M___________N(填“大于”或“小于”)。
②M中碳原子的杂化类型为___________,不同杂化类型的碳原子数之比为___________。
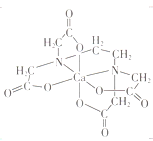
(3)碳的有机物常作为金属有机化合物的配体,如EDTA(乙二胺四乙酸)。EDTA与Ca2+形成的配离子如图所示。该配离子的配位数是___________,配体中碳原子的杂化方式有_________。
(4)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图所示,图中用实线标出了石墨的一个六方晶胞。

①石墨中C原子上未参与杂化的所有p轨道相互平行且重叠,使p轨道中的电子可在整个碳原子平面中运动而导电。六方氮化硼(BN)与石墨晶体结构类似,硼原子和氮原子交替相连,而六方BN却无法导电,其原因是___________。
②晶胞有两个基本要素:石墨一种晶胞结构和部分晶胞参数如图。

a.原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为A(0,0,0)、B(0,1,![]() ),则C原子的坐标参数为___________。
),则C原子的坐标参数为___________。
b. 晶胞参数用以描述晶胞的大小和形状。已知石墨晶胞底边长为acm,层间距为 d cm,阿伏加德罗常数的值为NA,则石墨的密度为___________g·cm-3(写出表达式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下各组列物质反应的化学方程式并指出反应类型:
(1)硫酸和Ba(OH)2溶液_____________、______________ ;
(2)盐酸和Na2CO3溶液____________、______________;
(3)H2O2溶液和MnO2混合_________、_________________;
(4)铝和氯化铜溶液__________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1 mol/L的HClO2和1 mol/L的HMnO4两种酸溶液,起始时的体积均为V0,分别向两溶液中加水稀释至体积为V,所得曲线如图所示。下列说法正确的是

A. 当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
B. 在0≤pH≤5时,HMnO4溶液满足:pH=lg(V/V0)
C. 常温下,浓度均为0.1mol·L-1的NaClO2和NaMnO4溶液的pH:NaMnO4>NaClO2
D. 稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于常温下pH=12的稀氨水,下列叙述不正确的是
A. 溶液中c (OH-)=1.010-2 mol·L-1
B. 由水电离出的c (OH-)=1.010-12 mol·L-1
C. 加水稀释后,氨水的电离程度增大
D. 加入少量NH4Cl固体,溶液pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某化工厂提供的硒酸泥(主要含S、Se、Fe2O3及SiO2)中提取粗硒的工艺流程如下图所示:

备注:氧化浸出液中Se的含量为43.45g/L
根据以上信息回答下列问题:
(1)把煤油加热后再进行浸泡的目的是:__________________________。
(2)将含硫的滤液进行“冷却、结晶、过滤”操作可以除去煤油中的硫,由这一操作可推测硫的物理性质是:__________________________。
(3)“氧化浸硒”过程中:
①需要控制H2SO4的浓度至少为3mol/L,理由是:__________________________。
②硒转化为H2SeO3并生成一种黄绿色的气体,此过程的化学方程式为_______________。
(4)要将1L氧化浸出液中的硒元素全部还原,需要至少加入Na2SO3_____mol;
(5)滤渣A的主要成分有___________;滤液B的金属阳离子有___________;
(6)处理硒酸泥的另一种方法是往硒酸泥中加入等体积的浓硫酸进行焙烧,本工艺流程与此方法相比主要的优点是(写两点):__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度1.18g/mL、质量分数为36.5%的浓盐酸配制250mL0.1mol/L的盐酸,回答下列问题:
(1)配制250mL0.1mol/L的盐酸
应量取的浓盐酸的体积/mL | 应选用的容量瓶的规格/mL | 除容量瓶外需要的其他仪器 |
____ | ____ | ____ |
(2)配制时,正确的操作顺序是____(填编号)。
A.用适量蒸馏水洗涤烧杯和玻璃棒2~3 次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入适量蒸馏水,用玻璃棒搅拌, 使其混合均匀
C.将已冷却的溶液沿玻璃棒注入所选容量瓶中
D.盖好瓶塞,上下颠倒摇匀
E 改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm 处
(3)操作A中,将洗涤液都注入容量瓶,其目的是______, 若无操作A,则所配溶液浓度____(填“偏大”、“偏小”或“不变”)
(4)E中加蒸馏水不慎超过了刻度线,则所配溶液浓度____(填“偏大”、“偏 小”或“不变”),应如何处理______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种易水解、受热易分解的白色固体,某研究小组用下图所示的实验装置制备氨基甲酸铵,反应原理为:2NH3(g)+CO2(g)=H2NCOONH4(s) △H<0。

(1)仪器B的名称是________________。
(2)打开阀门K,装置E中由固体药品所产生的气体就立即进入装置D,则该固体药品的名称为________________。
(3)装置D为制备氨基甲酸铵的反应器(CCl4充当惰性介质),在合适催化剂下搅拌一段时间。
①反应在冰水浴中进行的原因为_______________________________________。
②当CCl4液体中产生较多晶体悬浮物时,即停止反应,__________(填操作名称)分离得到粗产品。
(4)仪器G的作用有:_______________________________________。
(5)该实验装置中有一处不足,改进方法是______________________________________。
(6)已知氨基甲酸铵可完全水解为碳酸氢铵,则该反应的化学方程式_________________。
(7)为测定某样品中氨基甲酸铵的质量分数,某研究小组用该样品进行实验,已知杂质不参与反应,请补充完整测定某样品中氨基甲酸铵质量分数的实验方案(限选试剂:蒸馏水、澄清石灰水、Ba(OH)2溶液):用天平称取一定质量的样品,加水溶解,____________________,测量的数据取平均值进行计算。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4℃时在100mL水中溶解了22.4L氯化氢气体(在标准状况下测得)。下列关于所形成的溶液说法中,正确的是( )
A. 该溶液溶质的物质的量浓度为10mol·L-1
B. 若已知该溶液的密度,则可求得溶液溶质的物质的量浓度
C. 该溶液中含有0.1mol的Cl-
D. 该溶液的体积为22.5L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com