
����Ŀ��I��ʵ������50 mL 0.50mol/L���ᡢ50mL 0.55 mol/LNaOH��Һ����ͼ��ʾװ�ã����вⶨ�к��ȵ�ʵ�飬�õ����е����ݣ�

ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | |
���� | NaOH��Һ | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
����������⣺
(1)ͼ��ʵ��װ������ȱ�ٵIJ���������____________________________��
(2)�ڲ�����ȷ��ǰ���£�����к��Ȳⶨȷ�ԵĹؼ���________________________��
(3)�����ϱ����������ݽ��м��㣬���ʵ���õ��к��ȡ�H=_________[�����NaOH��Һ���ܶȰ�1g/cm3���㣬��Ӧ������Һ�ı�����(c)��4.18J/(g����)����]��
(4)����0.5 mol/L��������NaOH�������ʵ�飬��ʵ���в�õġ��к��ȡ���ֵ��_____���ƫ����ƫС���������䡱���������60 mL0.5moI/L��������50 mL 0.55mol/L��NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������______�����ȡ�����ȡ����������к���_____�����ȡ�����ȡ�����
(5) ����ʵ������ֵ��57.3�����ƫ�����ƫ���ԭ������ǣ�����ĸ��______��
A������������¶Ⱥ��¶ȼ�û����ˮ��ϴ�ɾ�
B. ����Ͳ�е�����������Һ����С�ձ�ʱ�����ٻ�
C������ʵ��ĵ������½ϸ�
D������ȡNaOH��Һʱ���Ӽ���
E.���ձ��ĸǰ��м�С��̫��
��ijС������H2C2O4��Һ������KMnO4��Һ��Ӧ��̽������������Ի�ѧ��Ӧ���ʵ�Ӱ�족��ʵ��ʱ���ȷֱ���ȡ������Һ��Ȼ�����Թ���Ѹ����Ͼ��ȣ���ʼ��ʱ��ͨ����ɫ����ʱ�����жϷ�Ӧ�Ŀ�������С����������·�����

��1����֪��Ӧ��H2C2O4ת��ΪCO2�ݳ���KMnO4ת��ΪMnSO4��Ϊ�˹۲쵽��ɫ��ȥ��H2C2O4��KMnO4��ʼ�����ʵ�����Ҫ����Ĺ�ϵΪn(H2C2O4)��n(KMnO4) ��_______��
��2�������Ţں͢�̽����������_____________��
��3��ʵ��ٲ��KMnO4��Һ����ɫʱ��Ϊ40s�����Ի��ǰ����Һ�����С�仯�����ʱ����ƽ����Ӧ����v(KMnO4)=__________mol��L-1��min-1��
���𰸡� ���β�������� ���װ�õı���Ч�� ��56.8 kJ��mol��1 ƫ�� ����� ��� ABDE 2.5(��5:2) �����������䣬�¶ȶԷ�Ӧ���ʵ�Ӱ�� 0.010
��������I��(1)��װ��ͼ��֪��װ������ȱ�ٵIJ��������ǻ��β����������
(2)�к��Ȳⶨʵ�����ҪĿ���Dz�����Ӧ�ų����������٣���������к��Ȳⶨȷ�ԵĹؼ������װ�õı���Ч����
(3)�ӱ�������֪������ʵ���¶Ȳ��ƽ��ֵΪ3.40�棬50 mL 0.50mol/L���ᡢ50mL 0.55 mol/LNaOH��Һ������m=100mL![]() 1g/mL=100g��c=4.18J/(g����),����Q=cm��T������0.025molˮ�ų�������Q=4.18J/(g����)
1g/mL=100g��c=4.18J/(g����),����Q=cm��T������0.025molˮ�ų�������Q=4.18J/(g����) ![]() 100g
100g![]() 3.40��=1421.2J=1.4212kJ����������1molˮ�ų�����Ϊ
3.40��=1421.2J=1.4212kJ����������1molˮ�ų�����Ϊ![]() =56.8kJ, ���ʵ���õ��к��ȡ�H=��56.8 kJ��mol��1��
=56.8kJ, ���ʵ���õ��к��ȡ�H=��56.8 kJ��mol��1��
(4)�������ƹ�������ˮ���ȷ�Ӧӳ���¶����ߣ��������õ�����ƫ������ʵ���в�õġ��к��ȡ���ֵ��ƫ��Ӧ�ų������������õ���ͼ�����������йأ�����60 mL0.5moI/L��������50 mL 0.55mol/L��NaOH��Һ���з�Ӧ��������ʵ����ȣ����ɵ�ˮ�����࣬���ų�������ƫ�ߣ������к��Ⱦ���ǿ����ǿ�Ӧ����1molˮʱ�ų����ȣ���������к�����ȡ�������ȷ��Ϊ��ƫ�� ������� �� ���
(5) A������������¶Ⱥ��¶ȼ�û����ˮ��ϴ�ɾ����ڲ����¶�ʱ���ᷢ������кͣ��¶ȼƶ����仯ֵ���С�����Ե���ʵ���в�õ��к�����ֵƫС����A��ȷ��B. ����Ͳ�е�����������Һ����С�ձ�ʱ�����ٻ����ᵼ��һ��������ɢʧ��ʵ���в�õ��к�����ֵƫС����B��ȷ��C������ʵ��������뷴Ӧ�ȵ������أ���C����D������ȡNaOH��Һʱ���Ӽ�������ʹʵ�ʲ������������Ҫ������������ڼ�������ų����Ȳ��䣬����Һ�������T��С������ʵ���õ��к�����ֵƫ�ͣ���D��ȷ��E.���ձ��ĸǰ��м�С��̫�ᵼ��һ��������ɢʧ������ʵ���õ��к�����ֵƫ�ͣ���E��ȷ����ˣ�������ȷ��ΪABDE��
��1�����ݷ�Ӧ��H2C2O4ת��ΪCO2�ݳ���KMnO4ת��ΪMnSO4�����û��ϼ��������д����Ӧ�Ļ�ѧ�����ǣ�2 KMnO4+5 H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2�����ӷ���ʽ֪����n(H2C2O4)��n(KMnO4)=5:2=2.5ʱ��Ӧǡ�÷�����Ϊ�˹۲쵽��ɫ��ȥ��KMnO4����Ӧ��������n(H2C2O4)��n(KMnO4) ��2.5��
��2��ʵ���Ţں͢۳����¶Ȳ�ͬ������������ȫ��ͬ������ʵ���Ţں͢�̽���������������������䣬�¶ȶԷ�Ӧ���ʵ�Ӱ�졣
��3��ʵ��ٲ�������ʵ���Ϊ��0.10mol/L![]() 0.002L=0.0002mol,������ص����ʵ���Ϊ��
0.002L=0.0002mol,������ص����ʵ���Ϊ��
0.010mol/L![]() 0.004L=0.00004mol��n(H2C2O4)��n(KMnO4)=0.0002:0.00004=5:1����Ȼ������������������ȫ��Ӧ����Ӧ��ʼʱ������ص�Ũ��Ϊ��
0.004L=0.00004mol��n(H2C2O4)��n(KMnO4)=0.0002:0.00004=5:1����Ȼ������������������ȫ��Ӧ����Ӧ��ʼʱ������ص�Ũ��Ϊ�� ![]() =
=![]() 0.010mol/L,
0.010mol/L,
���ʱ����ƽ����Ӧ����v(KMnO4)=  =0.010mol��L-1��min-1��
=0.010mol��L-1��min-1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����йػ�ѧ����ı�����ȷ���ǣ� ��
A.�ڻ�̬�����ԭ���У�p�����������һ������s�����������
B.��̬Feԭ�ӵ���Χ�����Ų�ͼΪ�� ![]()
C.����Ԫ�ص縺�Աȵ�Ԫ�ش���ԭ�ӵ�һ�����ܱȵ�ԭ�ӵ�һ�����ܴ�
D.����ԭ�Ӻ�������Ų����ص㣬Cu�����ڱ�������s��Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC5H10O2�����뱥��NaHCO3��Һ��Ӧ�ų�������л����У����������칹����������
A.2��
B.3��
C.4��
D.5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�������ϩ�ۺϴ�������Ҫ�ɷ֣��Ʊ���Ӧ���£�
��TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ��H1=+175.4KJ/mol
��C(s)+1/2O2(g)=CO(g) ��H2=-110.45 KJ/mol������˵����ȷ����

A. C��ȼ����Ϊ110.45KJ/mol
B. ��Ӧ����ʹ�ô�������Hl���С
C. ��Ӧ���е������仯��ͼ��ʾ
D. ��ӦTiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) ��H=-45.5KJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�ؼס��ҡ����������졢�����������ڱ��е����λ����ͼ���ײ�һ���ڶ������������ϣ����졢���ֱ��ǿ������ؿ��к�������Ԫ�ء������ж���ȷ����

A. ��һ���ǽ���Ԫ��
B. ��̬�⻯����ȶ��ԣ���>��>��
C. �ҡ������������������ˮ������������Ӧ
D. �������������ˮ����������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����Ҫ���л�����ԭ���л���X����ͼ������Ϊ��ʼԭ����Ƴ���ת����ϵͼ�����ֲ���ϳ�·�ߡ���Ӧ������ȥ����Y��һ�ֹ��ܸ߷��Ӳ��ϡ�
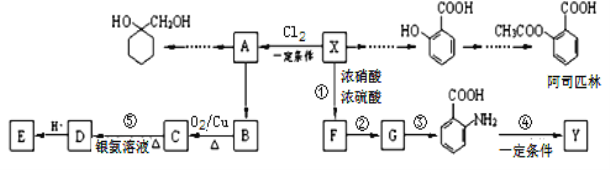
��֪����1��XΪ������������Է�������Ϊ92
��2��������ڸ�����ص������£��������������Ȼ���![]()
��3��![]() ���������ױ�������
���������ױ�������
����ݱ���������Ϣ����ѧ֪ʶ�ش��������⣺
��1��X�ķ���ʽΪ___________��
��2��![]() �к��������ŵ�����Ϊ___________________________��
�к��������ŵ�����Ϊ___________________________��
��3����Ӧ�ٵķ�Ӧ������_______________��
��֪AΪһ�ȴ����E�Ľṹ��ʽ��____________________________________��
��4����Ӧ���Ļ�ѧ����ʽΪ___________________________________________________________��
��5����д����AΪԭ���Ʊ�![]() �ĺϳ�·������ͼ�����Լ����ã���_________________��
�ĺϳ�·������ͼ�����Լ����ã���_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���ķ���ʽΪC5H10O�����ܷ���������Ӧ�ͼӳɷ�Ӧ����������H2�ӳɣ����ò���ṹ��ʽ�ǣ� ��
A.��CH3��2CCH2OH
B.��CH3CH2��2CHOH
C.CH3��CH2��3CH2OH
D.CH3CH2C��CH3��2OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��龧���л�ѧ�����ͺ;������;���ͬ���ǣ�������
A.��������Ͷ�����̼
B.���ʯ��ʯī
C.�Ȼ��ƺ�������
D.����ͭ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com