
【题目】下表为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为 _________ mol/L;
(2)某学生欲用上述浓盐酸和蒸馏水配制480mL 物质的量浓度为0.400mol/L的稀盐酸,
①该学生需要量取__________ mL上述浓盐酸进行配制;
②所需玻璃仪器有:玻璃棒、烧杯、量筒、__________ 、__________ ;
③在配制过程中,下列实验操作会导致所配制的稀盐酸的物质的量浓度偏高的有__________ 。
A.定容时,俯视容量瓶刻度线进行定容;
B.在烧杯中将浓盐酸进行稀释后立即转入容量瓶;
C.转移溶液时,不慎有少量溶液洒到容量瓶外面;
D.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水;
E.定容摇匀后,发现液面低于刻度线,再加蒸馏水至刻度线。
【答案】11.9 16.8 500mL容量瓶 胶头滴管 AB
【解析】
依据c=![]() 计算浓盐酸物质的量浓度;
计算浓盐酸物质的量浓度;
(2)①依据溶液稀释过程中所含溶质的物质的量保持不变计算需要浓盐酸体积;
②根据配制物质的量浓度的溶液的步骤确定使用的仪器,然后结合实验用到的基本仪器已有烧杯、玻璃棒、量筒,可知缺少的仪器有500ml容量瓶、胶头滴管;
③分析操作对溶质的物质的量和溶液体积的影响,依据c=![]() 进行误差分析。
进行误差分析。
(1)根据物质的量浓度与质量分数的换算式可知该浓盐酸中HCl的物质的量浓度c=![]() mol/L=11.9mol/L;
mol/L=11.9mol/L;
(2)①实验室没有规格是480mL的容量瓶,根据选择仪器的标准是“大而近”的原则,选择使用500mL的容量瓶。由于溶液在稀释前后溶质的物质的量不变,设需要浓盐酸体积为V,可得V×11.9mol/L=0.400molL-1×500mL,解得V=16.8mL;
②实验用到的基本仪器已有烧杯、玻璃棒、量筒,胶头滴管,500ml容量瓶;所以差500ml容量瓶、胶头滴管;
③A.定容时,俯视容量瓶刻度线进行定容,则溶液的体积偏小,根据c=![]() 可知V偏小,则配制的溶液的浓度偏高,A符合题意;
可知V偏小,则配制的溶液的浓度偏高,A符合题意;
B.浓盐酸溶于水放出热量,在烧杯中将浓盐酸进行稀释后立即转入容量瓶,由于溶液温度高于室温,当溶液恢复至室温后,溶液的液面低于刻度线,使V偏小,则根据c=![]() 可知V偏小,则配制的溶液的浓度偏高,B符合题意;
可知V偏小,则配制的溶液的浓度偏高,B符合题意;
C.转移溶液时,不慎有少量溶液洒到容量瓶外面,导致溶质的物质的量减少,根据c=![]() 可知n偏小,则配制的溶液的浓度偏低,C不符合题意;;
可知n偏小,则配制的溶液的浓度偏低,C不符合题意;;
D.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水,由于不影响溶质的物质的量和溶液的体积,因此对配制的溶液的浓度无影响,D不符合题意;
E.定容摇匀后,由于一部分溶液粘在容量瓶的瓶颈上,使溶液的液面低于刻度线,但若再加蒸馏水至刻度线,会对原来配制的溶液起稀释作用,导致溶液的浓度偏低,E不符合题意;
故合理选项是AB。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】中国海军航母建设正在有计划、有步骤向前推进,第一艘国产航母目前正在进行海试。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为___________,铬元素在周期表中___________区。
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为___________杂化。

(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___________填元素符号

②根据价层电子对互斥理论,预测ClO3-的空间构型为___________形,写出一个ClO3-的等电子体的化学符号___________。
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、铁、锰、锌等。如右图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?___________(填“是”或“否”);该立方体是不是Fe3O4的晶胞?___________(填“是”或“否”);立方体中铁离子处于氧离子围成的___________(填空间结构)空隙;根据上图计算Fe3O4晶体的密度为___________g·cm-3。(图中a=0.42nm,计算结果保留两位有效数字)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应,又属于置换反应的是( )
A.3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
B.CO2+Ca(OH)2=CaCO3↓+H2O
C.Fe2O3 +3CO![]() 2Fe+3CO2
2Fe+3CO2
D.2Na+Cl2![]() 2NaCl
2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH===5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。下列说法中正确的是( )

A. 电解过程中OH-从a极区通过离子交换膜c进入b极区
B. 随着电解进行,KOH溶液浓度会逐渐减小
C. a电极反应式:I--6e-+6OH-=== IO![]() +3H2O,a极区的KI最终转变为KIO3
+3H2O,a极区的KI最终转变为KIO3
D. 当阳极有0.1 mol I-放电时,阴极生成6.72 L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物P是合成抗肿瘤药物的中间体,其合成路线如下:

已知: ![]()
(1)A可与NaHCO3溶液反应,写出A的官能团名称_____。
(2)A→B的反应类型_____。
(3)C→D的化学方程式_____。
(4)检验F中官能团的试剂及现象_____。
(5)G→H所需的试剂a是______。
(6)D→E的化学方程式______。
(7)已知:
K经过多步反应最终得到产物P:

①L的结构简式___________。
②Q→M的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g)的能量变化如图所示,有关叙述中不正确的是( )
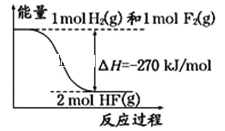
A. 氟化氢气体分解生成氢气和氟气的反应是吸热反应
B. 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C. 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D. 断裂1 mol H﹣H键和1 mol F﹣F 键吸收的能量小于形成2 mol H﹣F键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于隐形眼镜材料的聚合物片段如下:

下列关于该高分子说法正确的是
A. 结构简式为:
B. 氢键对该高分子的性能没有影响
C. 完全水解得到的高分子有机物,含有官能团羧基和碳碳双键
D. 完全水解得到的小分子有机物,具有4种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M、N相比,较稳定的是__________。
(2)根据下列热化学方程式分析,C(s)的燃烧热△H等于_____________ (用△H1 、△H2、△H3表示)
C(s)+H2O(l)=CO(g)+H2(g); △H1
2CO(g)+O2(g)=2CO2(g); △H2
2H2(g)+O2(g)=2H2O(l); △H3
(3) 根据键能数据估算CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH=________。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
CH4的结构如图所示
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:____________________________。
(5)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s) =2Al2O3(s)+3TiC(s) ΔH= -1176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠(NaCN)是一种基本化工原料,同时也是一种剧毒物质。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠(Na2S2O8)溶液来处理,以减轻环境污染。
I.(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式是____________________。
Ⅱ.工业制备过硫酸钠的反应原理如下:
主反应![]()
副反应:![]()
某化学小组利用上述原理在实验室制备过硫酸钠,并用过硫酸钠溶液处理含氰化钠的废水。
实验一:实验室通过如下图所示装置制备Na2S2O8。

(2)装置中盛放双氧水的仪器名称是_________。
(3)装置a中反应产生的气体需要持续通入装置c的原因是______________________。
(4)上述装置中还需补充的实验仪器或装置有__________(填字母)。
A.温度计 B.洗气瓶 C.水浴加热装置 D.环形玻璃搅拌棒
实验二:测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L。
②![]() ,
,![]() ,AgI呈黄色,
,AgI呈黄色,![]() 优先与
优先与![]() 反应。实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用
反应。实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用![]() mol/L的标准
mol/L的标准![]() 溶液滴定,消耗
溶液滴定,消耗![]() 溶液的体积为5.00mL。
溶液的体积为5.00mL。
(5)滴定终点的现象是__________________________________。
(6)处理后的废水中氰化钠的浓度为_________mg/L;处理后的废水是否达到排放标准?___________(填“是”或“否”)。
Ⅲ.(7)常温下,含硫微粒主要存在形式,受pH影响。利用电化学原理,用惰性电极电解饱和![]() 溶液也可以制备过硫酸钠。已知在阳极放电的离子主要为
溶液也可以制备过硫酸钠。已知在阳极放电的离子主要为![]() ,则阳极反应方程式为_____________________。
,则阳极反应方程式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com