
【题目】氰化钠(NaCN)是一种基本化工原料,同时也是一种剧毒物质。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠(Na2S2O8)溶液来处理,以减轻环境污染。
I.(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式是____________________。
Ⅱ.工业制备过硫酸钠的反应原理如下:
主反应![]()
副反应:![]()
某化学小组利用上述原理在实验室制备过硫酸钠,并用过硫酸钠溶液处理含氰化钠的废水。
实验一:实验室通过如下图所示装置制备Na2S2O8。

(2)装置中盛放双氧水的仪器名称是_________。
(3)装置a中反应产生的气体需要持续通入装置c的原因是______________________。
(4)上述装置中还需补充的实验仪器或装置有__________(填字母)。
A.温度计 B.洗气瓶 C.水浴加热装置 D.环形玻璃搅拌棒
实验二:测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L。
②![]() ,
,![]() ,AgI呈黄色,
,AgI呈黄色,![]() 优先与
优先与![]() 反应。实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用
反应。实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用![]() mol/L的标准
mol/L的标准![]() 溶液滴定,消耗
溶液滴定,消耗![]() 溶液的体积为5.00mL。
溶液的体积为5.00mL。
(5)滴定终点的现象是__________________________________。
(6)处理后的废水中氰化钠的浓度为_________mg/L;处理后的废水是否达到排放标准?___________(填“是”或“否”)。
Ⅲ.(7)常温下,含硫微粒主要存在形式,受pH影响。利用电化学原理,用惰性电极电解饱和![]() 溶液也可以制备过硫酸钠。已知在阳极放电的离子主要为
溶液也可以制备过硫酸钠。已知在阳极放电的离子主要为![]() ,则阳极反应方程式为_____________________。
,则阳极反应方程式为_____________________。
【答案】NaCN+H2O2+H2O=NH3↑+NaHCO3 分液漏斗 将产生的氨气及时排除,防止发生副反应 AC 滴入最后一滴标准硝酸银溶液,锥形瓶中溶液恰好产生黄色沉淀,且半分钟沉淀不消失 0.49 是 2HSO4--2e-=S2O82-+2H+
【解析】
(1)由题意知产生的气体为氨气,又由于产生酸式盐,由CN-分析碳元素的价态,应有碳酸氢根离子生成,据此可写出化学方程式;
(2)(3)(4)(NH4)2S2O8与氢氧化钠反应生成Na2S2O8,d装置处理尾气NH3,根据物质的制备和实验操作及注意事项分析解答;
(5)当CN-反应完全后,硝酸银试剂与指示剂碘离子反应生成黄色沉淀碘化银;
(6)根据化学计量关系Ag+~2CN-,计算废水中氰化钠的浓度,并与排放标准为0.50mg/L比较,以此判断是否达到排放标准;
(7)根据电解池阳极发生氧化反应分析。
(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,即反应生成了NaHCO3和NH3,化学方程式为NaCN+H2O2+H2O=NH3↑+NaHCO3,
故答案为:NaCN+H2O2+H2O=NH3↑+NaHCO3;
(2)由仪器构造可知,装置中盛放双氧水的仪器名称是分液漏斗,
故答案为:分液漏斗;
(3) 装置a中反应产生O2,将三颈烧瓶中产生的NH3及时排出,减少副反应的发生,
故答案为:将产生的氨气及时排除,防止发生副反应;
(4) 根据题目信息提示,可知,制备反应需要在55℃的条件下进行,90℃时发生副反应,所以需要控制温度不能超过90℃,需要水浴加热、温度计,
故答案为:AC;
(5) 用硝酸银溶液滴定过程中,当滴入最后一滴标准硝酸银溶液,溶液中出现黄色沉淀,且半分钟沉淀不消失,说明已经滴定到终点,
故答案为:滴入最后一滴标准硝酸银溶液,锥形瓶中溶液恰好产生黄色沉淀,且半分钟沉淀不消失;
(6)消耗AgNO3的物质的量为1.0×10-3L×5.00×10-3 mol·L-1=5.0×0-6mol,根据化学计量关系可知,Ag+~2CN-,处理后的10.00 mL废水中氰化钠的质量为5.0×0-6mol×2×49 g·mol-1=4.9×10-4 g,废水中氰化钠的含量为![]() =0.49mg·L-1<0.50 mg·L-1,所以处理后的废水已达到排放标准,
=0.49mg·L-1<0.50 mg·L-1,所以处理后的废水已达到排放标准,
故答案为:0.49;是;
(7)电解池阳极发生氧化反应,HSO4-失电子生成S2O82-,根据电子守恒、电荷守恒、原子守恒书写阳极反应方程式为2HSO4--2e-=S2O82-+2H+,
故答案为:2HSO4--2e-=S2O82-+2H+。


科目:高中化学 来源: 题型:
【题目】下表为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为 _________ mol/L;
(2)某学生欲用上述浓盐酸和蒸馏水配制480mL 物质的量浓度为0.400mol/L的稀盐酸,
①该学生需要量取__________ mL上述浓盐酸进行配制;
②所需玻璃仪器有:玻璃棒、烧杯、量筒、__________ 、__________ ;
③在配制过程中,下列实验操作会导致所配制的稀盐酸的物质的量浓度偏高的有__________ 。
A.定容时,俯视容量瓶刻度线进行定容;
B.在烧杯中将浓盐酸进行稀释后立即转入容量瓶;
C.转移溶液时,不慎有少量溶液洒到容量瓶外面;
D.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水;
E.定容摇匀后,发现液面低于刻度线,再加蒸馏水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g)![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动②升高温度,平衡向逆反应方向移动,v(正)减小③压强增大一倍,平衡不移动,v(正)、v(逆)不变 ④增大B的浓度,v(正)>v(逆) ⑤加入催化剂,B的转化率提高
A. ①② B. ④ C. ③ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为V L的密闭容器中进行反应,M、N两种气体的物质的量随时间的变化曲线如图所示:

(1)该反应的生成物是___________;
(2)该反应的化学反应方程式为_____________;
(3)到t2时刻,以M的浓度变化表示的平均反应速率为____________;
(4)若达到平衡状态的时间是4 min,N物质在该4 min内的平均反应速率为1.5mol·L-1·min-1,则此容器的容积V=____________L。
(5)达到平衡状态时,反应物的转化率为____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 在微生物作用的条件下,NH![]() 经过两步反应被氧化成NO
经过两步反应被氧化成NO![]() 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:

① 第一步反应是________(填“放热”或“吸热”)反应,判断依据是_______________________。
② 1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是__________________________。
(2) 已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)===2P2O5(s) ΔH1;4P(红磷,s)+5O2(g)===2P2O5(s) ΔH2;ΔH1和ΔH2的关系是ΔH1________ΔH2 (填“>”“<”或“=”)。
(3) 在298 K、101 kPa时,已知:
2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2之间的关系正确的是________。
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 向盐酸中加入氨水至中性,溶液中![]()
B. 在蒸馏水中滴加浓H2SO4,Kw不变
C. 向0.1 mol/L CH3COOH溶液中加入少量水,溶液中![]() 增大
增大
D. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠是日常生活的必需品,也是重要的化工原料。粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。

限选试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
(1)欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、______、____。
(2)在滤液中加盐酸发生反应的化学方程式是_____;
(3)对溶液II处理得到晶体时,所必须使用到的玻璃仪器有_____种。
(4)得到的NaCl纯品经测定发现其含有的NaCl与粗盐中NaCl的质量一致,某同学认为此次实验非常成功没有误差,你是否同意他的观点?____(填“是”或“否”),并给出你的理由____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂、反应条件和产物已略去):

已知:I、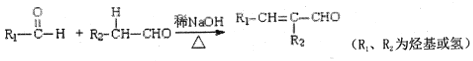
II、
(1)A分子的名称为______,B分子中所含官能团的名称为_______,由C到D的反应类型为_______;
(2)乙炔和羧酸X发生加成反应生成E,E的核磁共振氢谱有三组峰,且峰面积比为3:2:1,E能发生水解反应,则E的结构简式为_______;
(3)D和G反应生成光刻胶的化学方程式为______;
(4)C的同分异构体满足下列条件:
①能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应;
②分子中只有一个环状结构。满足上述条件的同分异构体有______种。其中苯环上的一氯取代产物只有两种的同分异构体的结构简式为:_______
(5)根据已有知识并结合本题信息,写出以 CH3CHO为原料制备CH3COCOCOOH的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiCO3常用于催化剂、电镀、陶瓷等工业。现用某含镍电镀废渣(含Cu、Zn、Fe、Cr等杂质)制取NiCO3的过程如图所示:

(1)流程中的试剂X(某钠盐)的化学式是___________。
(2)“氧化”时需保持滤液在40℃左右,用6%的H2O2溶液氧化。控制温度不超过40℃的原因是______(用化学方程式表示)。
(3)Fe2+也可以用NaClO3氧化,生成的Fe3+在较小pH条件下水解,最终形成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀而被除去,如图是pH—温度关系图,图中阴影部分为黄钠铁矾稳定存在的区域,下列说法不正确的是________(填字母)。

a.黄钠铁矾[Na2Fe6(SO4)4(OH)12]中铁为+2价
b.pH过低或过高均不利于生成黄钠铁矾,其原因相同
c.氯酸钠在氧化Fe2+时,1 mol NaClO3得到的电子数为6NA
d.工业生产中温度常保持在85~95 ℃,加入Na2SO4后生成黄钠铁矾,此时溶液的pH约为1.2~1.8。
(4)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是_______________。
(5)某小组利用NiCO3制取镍氢电池的正极材料碱式氧化镍(NiOOH),过程如图:

①已知 25℃时,Ksp[Ni(OH)2]=2×10-15,当调节 pH≥9 时,溶液中残留的c(Ni2+)________mol/L。
②写出在空气中加热Ni(OH)2制取NiOOH的化学方程式________________。
③镍氢电池电解液为30%的KOH,负极为MH(即吸氢材料M吸附氢原子)。充电时也可实现Ni(OH)2转化为NiOOH。请写出放电时该电池的总反应式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com