
����Ŀ����������������������������ͻ���ϢϢ��ء�
(1)NO���ٳ����㱻�ƻ����䷴Ӧ������ͼ��ʾ��
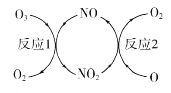
��NO��������________________________��
����֪��O3(g)+O(g) ��2O2(g) ��H=-143kJ��mol-1
��Ӧl��O3(g)+NO(g) ��NO2(g)+O2(g)��H1=-200.2kJ��mol-1
��Ӧ2���Ȼ�ѧ����ʽΪ____________________________��
(2)���쵰��(Mb)�Ǽ����ڴ������ĵ����ʣ����ɼ��쵰�ĸʰ���(H2NCH2COOH)��һ���������ʣ�����Һ��������������ʽ���ڣ���ת����ϵ����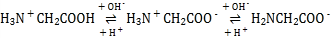 �������ӵ����ʵ�������(��)��[
�������ӵ����ʵ�������(��)��[![]() ]�Ĺ�ϵ��ͼ��ʾ��
]�Ĺ�ϵ��ͼ��ʾ��
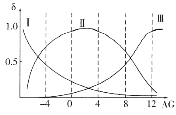
����Һ������ʱ����������Ũ���ɴ�С��˳��Ϊ______________________��
����AG=12����Һ�м������NaOH��Һʱ����Ҫ��Ӧ�����ӷ���ʽΪ______________��
(3)���쵰��(Mb)����O2�������MbO2��![]() ��37��ʱ��ü��쵰�Ľ�϶�(��)��p(O2)�Ĺ�ϵ���±���
��37��ʱ��ü��쵰�Ľ�϶�(��)��p(O2)�Ĺ�ϵ���±���
[��϶�(��)ָ����O2��ϵļ��쵰��ռ�ܼ��쵰�����ʵ�������]
p(O2)��kPa | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
��(MbO2)% | 50.0 | 66.7 | 80.0 | 85.7 | 88.9 | 90.9 | 92.3 |
�ټ���37��ʱ��������Ӧ��ƽ�ⳣ��K=__________kPa-1(�������Һ�е����ʷֱ��÷�ѹ�����ʵ���Ũ�ȱ�ʾ)��
��37��ʱ����������������ѹΪ21.0 kPa��������������ʱ�������ֵΪ________��(����1λС��)��
���¶Ȳ���ʱ���ο���ɽ��ʱ����MbO2��Ũ�ȱ���ɽ��________(����������������)��
���о����֣�v��=k����c(Mb)��p(O2)��v��=k
���𰸡����� NO2��g��+O��g��=NO(g)+O2(g) ��H=+57.2KJ/mol c(H3N+CH2COO��)>c��H2NCH2COO����>c(H3N+CH2COOH) H3N+CH2COOH+2OH��= H2NCH2COO��+2H2O 2 97.7 �� 120s-1 KPa-1
��������
(1)��NOֻ�Dz��뻯ѧ��Ӧ�м����̵ģ����䱾���������ͻ�ѧ�����ڷ�Ӧǰ��������ֲ��䣻
�����ø�˹���ɽ��⣻
(2)���ź����������Լ�����������ǿ������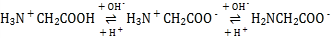 ��֪H2NCH2COO������Խǿ����Խ��H3N+CH2COO���ڽӽ�����ʱ�������H3N+CH2COOH����Խǿ����Խ���ɴ�ȷ������ΪH2NCH2COO��,����ΪH3N+CH2COO��,����ΪH3N+CH2COOH���Դ˷�����
��֪H2NCH2COO������Խǿ����Խ��H3N+CH2COO���ڽӽ�����ʱ�������H3N+CH2COOH����Խǿ����Խ���ɴ�ȷ������ΪH2NCH2COO��,����ΪH3N+CH2COO��,����ΪH3N+CH2COOH���Դ˷�����
(3)��K=![]() kPa-1�����ñ��������ݽ��м��㣻
kPa-1�����ñ��������ݽ��м��㣻
�����â��м����K���㼴�ɣ�
�۸��ݱ����ṩ���ݿ�֪p(O2)ԽС����϶�Խ�ͣ�c��MbO2��ԽС��
�����â��м����K������ƽ��ʱv��= v�����м��㣻
(1)��NOֻ�Dz��뻯ѧ��Ӧ�м����̵ģ����䱾���������ͻ�ѧ�����ڷ�Ӧǰ��������ֲ��䣬���NO�������Ǵ�����
�𰸣�����
�����ø�˹���ɣ�������֪��O3(g)+O(g) =2O2(g) ��H=-143kJ��mol-1
O3(g)+NO(g) =NO2(g)+O2(g)��H1=-200.2kJ��mol-1
ǰ��ȥ���߿ɵã�NO2��g��+O��g��=NO(g)+O2(g) ��H=+57.2kJ/mol
�𰸣�NO2��g��+O��g��=NO(g)+O2(g) ��H=+57.2kJ/mol
(2)�����ź����������Լ�����������ǿ��������ɿ�֪����ԽǿH2NCH2COO������Խ����AG=0��4��ΧʱH3N+CH2COO�������������ԽǿH3N+CH2COOH����Խ���ɴ�ȷ������ΪH2NCH2COO��,����ΪH3N+CH2COO��,����ΪH3N+CH2COOH����Һ������Ҳ����AG=0����������Ũ���ɴ�С��˳��ɸ���ͼ��õ�Ϊc(H3N+CH2COO��)>c��H2NCH2COO����>c(H3N+CH2COOH)��
�𰸣�c(H3N+CH2COO��)>c��H2NCH2COO����>c(H3N+CH2COOH)
�ڸ���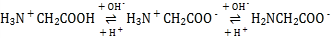 ��֪�������NaOH��Һʱ��Һ����Ҫ����H2NCH2COO-��AG=12ʱ��Һ����Ҫ����H3N+CH2COOH���ݴ�д�����ӷ���ʽΪ: H3N+CH2COOH+2OH��= H2NCH2COO��+2H2O��
��֪�������NaOH��Һʱ��Һ����Ҫ����H2NCH2COO-��AG=12ʱ��Һ����Ҫ����H3N+CH2COOH���ݴ�д�����ӷ���ʽΪ: H3N+CH2COOH+2OH��= H2NCH2COO��+2H2O��
�𰸣�H3N+CH2COOH+2OH��= H2NCH2COO��+2H2O
(3)��K=![]() kPa-1�����ñ����е�һ�����ݿ�֪���輡�쵰����Ũ��c
kPa-1�����ñ����е�һ�����ݿ�֪���輡�쵰����Ũ��c
![]()
c����1-50%�� 0.50kPa c��50%
K=![]() =2
=2
�����â��м�������K=2���㼴�ɣ�
2=![]() ������=97.7��
������=97.7��
�𰸣�97.7
�۸��ݱ����ṩ���ݿ�֪p(O2)ԽС����϶�Խ�ͣ� MbO2Ũ��Խ�ͣ�
�𰸣���
�����â��м����K=2������ƽ��ʱv��= v�����м��㣻
ƽ��ʱv��= v���� ��k����c(Mb)��p(O2)=k����c(MbO2)����K��=![]() = k����K=60s-1��2kPa-1=120s-1 KPa-1��
= k����K=60s-1��2kPa-1=120s-1 KPa-1��
��: 120s-1 KPa-1


 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ����״��ͱ�����Ļ�ѧԭ���ǣ� ��
�� ����֪����ȩ�ױ��������������״��ķе�Ϊ205.3������������۵�Ϊ121.7�����е�Ϊ249���������£���ˮ�е��ܽ��Ϊ0.34g�����ѵķе�Ϊ34.8����������ˮ���Ʊ����״��ͱ��������Ҫ����������ʾ��
����֪����ȩ�ױ��������������״��ķе�Ϊ205.3������������۵�Ϊ121.7�����е�Ϊ249���������£���ˮ�е��ܽ��Ϊ0.34g�����ѵķе�Ϊ34.8����������ˮ���Ʊ����״��ͱ��������Ҫ����������ʾ��

�Ը���������Ϣ�ش��������⣺
(1)����I��������________��������Һ�����ܽ����Ҫ�ɷ���____________��
(2)��������������________����Ʒ����________��
(3)��������������________����Ʒ����________��
(4)��ͼ��ʾ�����������¶ȼ�ˮ�������ط��õ�λ��Ӧ��____������a������b������c�� ����d�������ռ����Ѳ�Ʒ�������¶�Ϊ___��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶���,���淴Ӧ2NO2(g) ![]() 2NO(g)+O2(g)������̶����ܱ������з�Ӧ,�ﵽƽ��״̬�ı�־��
2NO(g)+O2(g)������̶����ܱ������з�Ӧ,�ﵽƽ��״̬�ı�־��
�ٵ�λʱ��������nmol O2,ͬʱ����2nmol NO2 �ڻ��������ܶȲ��ٱ仯
����NO2��NO��O2�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2��2��1
�ܻ�������ѹǿ���ٸı� �ݻ���������ɫ���ٸı�
��������ƽ����Է����������ٸı�
A. ����ȫ�� B. �٢ڢۢ� C. �ڢۢݢ� D. �٢ܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij���淴Ӧ��mA(g)+nB��g��![]() xC(g) ����=QkJ/mol �����ܱ������н��У���ʾ��Ӧ�ڲ�ͬʱ��t ���¶�T��ѹǿP��C�ڻ�������еİٷֺ�����C%���Ĺ�ϵ���ߣ���
xC(g) ����=QkJ/mol �����ܱ������н��У���ʾ��Ӧ�ڲ�ͬʱ��t ���¶�T��ѹǿP��C�ڻ�������еİٷֺ�����C%���Ĺ�ϵ���ߣ���

A. T1��T2 ��P1��P2 ��m+n��x ��Q��0
B. T1��T2 ��P1��P2 ��m+n��x ��Q��0
C. T1��T2 ��P1��P2 ��m+n��x ��Q��0
D. T1��T2 ��P1��P2 ��m+n��x ��Q��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ��ɱ���ܱ�������ͨ��һ������X,������Ӧ:mX(g)![]() nY(g)+Z(g)��H=QkJ��mol-1����Ӧ�ﵽƽ��ʱ,Y�����ʵ���Ũ�����¶ȡ���������Ĺ�ϵ�����ʾ:
nY(g)+Z(g)��H=QkJ��mol-1����Ӧ�ﵽƽ��ʱ,Y�����ʵ���Ũ�����¶ȡ���������Ĺ�ϵ�����ʾ:
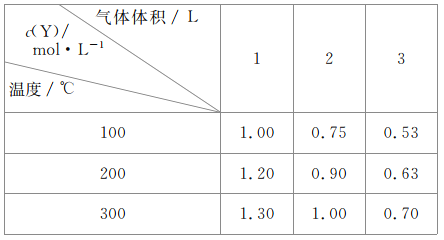
����˵����ȷ����
A.m��n+1
B.�¶Ȳ��䣬ѹǿ����Y�������������
C.Q��0
D.������䣬�¶����ߣ�ƽ�����淴Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦA��g��![]() B��g��
B��g��
��1���÷�Ӧ�����ʷ��̿ɱ�ʾΪV��=K��CA��V��=K��CB��K����K����һ���¶�ʱΪ�������ֱ���������淴Ӧ���ʳ�������֪T1�¶��£�K��=0.004s-1 ��K��=0.002s-1�����¶��·�Ӧ��ƽ�ⳣ��ֵK=______���÷�Ӧ�Ļ��Ea(��)����Ea(��)����![]() ____0(�>����<����=��)��
____0(�>����<����=��)��
��2�����ڸ÷�ӦA��g��![]() B��g������313 K��353 KʱA��ת������ʱ��仯�Ľ����ͼ��ʾ��
B��g������313 K��353 KʱA��ת������ʱ��仯�Ľ����ͼ��ʾ��

����313 Kʱ��Ӧ��ƽ��ת������=_______%��ƽ�ⳣ��K313 K___K353 K���>����<����=������������________________________________��
����353 K�£�Ҫ���A��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��___________��Ҫ���̷�Ӧ�ﵽƽ���ʱ�䣬�ɲ�ȡ�Ĵ�ʩ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����5 mL NaCl��Һ�е���һ��AgNO3��Һ�����ְ�ɫ�����������μ�һ��KI��Һ����������Ϊ��ɫ���ٵ���һ��Na2S��Һ���������ֱ�ɺ�ɫ�����������仯���̣����������ֳ�������ܽ�ȹ�ϵΪ
A. AgCl��AgI��Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��25 ��ʱ��CH3COOH��NH3��H2O�ĵ��볣����ȡ�
��1��25 ��ʱ��ȡ10 mL 0.1 mol��L-1������Һ�����pH��3��
�ٽ�������1����Һ��ˮϡ����1 000 mL����ҺpH��ֵ��ΧΪ___________����Һ��c(CH3COO-)/[c(CH3COOH)��c(OH-)]___________����������������С������������������ȷ��������
��25 ��ʱ��0.1 mol��L-1��ˮ��NH3��H2O��Һ����pH��___________����pH��ֽ�ⶨ�ð�ˮpH�IJ�������Ϊ_______________________________________________________��
�۰�ˮ��NH3��H2O��Һ������ƽ�ⳣ������ʽKb��_______________________________��25 ��ʱ����ˮ����ƽ�ⳣ��ԼΪ___________��
��2��25 ��ʱ������10 mL 0.1 mol��L-1��ˮ�еμ���ͬŨ�ȵ�CH3COOH��Һ���ڵμӹ�����c(NH4+)/c(NH3.H2O)___________������ţ���
a��ʼ�ռ�С b��ʼ������ c���ȼ�С������ d����������С
��3��ij�¶��£���V1mL 0.1 mol��L-1NaOH��Һ����μ����Ũ�ȵĴ�����Һ����Һ��pOH��pH�ı仯��ϵ��ͼ����֪��pOH��- lgc(OH-)��
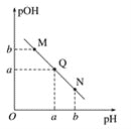
ͼ��M��Q��N������ʾ��Һ�����Եĵ���___________������ĸ����ͬ����
ͼ��M��Q��N������ʾ��Һ��ˮ�ĵ���̶����ĵ������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2.7g���ܽ���100mL 3 mol��L-1 NaOH��Һ�У�Ȼ����������Һ�м���400mL 1 mol��L-1���ᣬ���ɵó����������ǣ���
A.2.7gB.5.2gC.7.8gD.10g
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com