
【题目】下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是
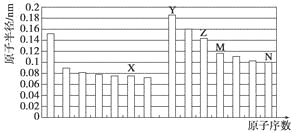
A. Z、N两种元素的离子半径相比,前者较大
B. X、N两种元素的气态氢化物的沸点相比,前者较低
C. 由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D. Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
【答案】D
【解析】试题分析:同周期从左到右原子半径减小,同主族元素从上而下原子半径增大,故前7种元素处于第二周期,后7中元素处于第三周期,由原子序数可知,X为氧元素,Y为钠元素,Z为铝元素,M为硅元素,N为硫元素,N为氯元素。A、Z、N两种元素的离子分别为钠离子和氯离子,最外层电子数相同,电子层越多离子半径越大,故离子半径钠离子小于氯离子,A错误;B、非金属性氧大于氯,非金属性越强氢化物越稳定,故稳定性水大于氯化氢,B错误;C、由X与M两种元素组成的化合物是二氧化硅,能与氢氟酸反应,C错误;D、氧化铝是良性氧化物,能与氢氧化钠反应生成偏铝算钠,能与盐酸反应生成氯化铝,D正确;答案选D。


科目:高中化学 来源: 题型:
【题目】(1)固体正盐A, 可以发生如右图所示反应,其中E、I为中学常见的两强酸,则:
![]()
①A为_____________;
②F![]() G的化学方程式为______________________;
G的化学方程式为______________________;
③Fe与少量I的稀溶液反应的离子方程式______________________________________。
④若CO2气体中混有少量C,欲除去C时,最好选用_______试剂;
(2)铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
① 铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第_____周期,第____族;
② PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为________________;
③ PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为______________;
④ PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0% (即![]() )的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,计算x的值和m :n的值x=_______;m :n=________。
)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,计算x的值和m :n的值x=_______;m :n=________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份.
(1)将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图.混合物中n[(NH4)2SO4]:n(NH4Cl)为 . 
(2)另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl﹣=(溶液体积变化忽略不计).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氧化还原反应中: 3S +6KOH=K2SO3+2K2S+3H2O中,被氧化与被还原的原子个数之比为
A. 1:2 B. 2:1 C. 3:2 D. 2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气质量与我们的健康息息相关,目我国通过检测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2、和CO是其中3项中的污染物.
(1)上述3种气体直接排入空气后会引起酸雨的气体有(填化学式).
(2)处理酸雨市场采用NaClO2溶液作为吸收剂,可同时对烟气进行脱硫、脱硝,其中脱硫反应ClO2﹣+2SO32﹣2SO42﹣+Cl﹣ , 该反应的平衡常数K的表达式为;
(3)利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,写出电极A的电极方程式 , 当标况下有4.48L被处理时,通过电极B的电子数为 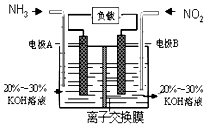
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下,X和H是固体,其中X属于离子化合物,1 mol X分解得到A、B、C的物质的量之比为1 : 1 : 2 ; B和G是液体,其余均为气体。
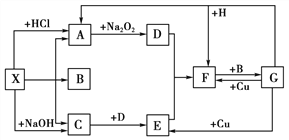
试解答下列各题:
(1)写出下列物质的化学式:X________,B________,G______________
(2)写出下列反应的化学方程式:
C+D→E:______________
A→D:______________
G + H→A+F:______________
(3)写出下列反应的离子方程式:
G+Cu→E:______________
(4)工业上合成C,合成后采用加压降温液化方法从混合气体中分离出C,能用上述方法分离出C的原因是______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期主族元素,其原子序数依次增大。其中A元素原子核内只有一个质子;A与C、B与D分别同主族;B、D两元素原子序数之和是A、C两元素原子序数之和的2倍。
请回答下列问题:
(1)由上述元素组成的下列物质中属于非电解质的是________(填字母)。
A.C2B2 B.DB2 C.E2 D.C2DB3
(2)D元素在元素周期表中的位置为_______________________________;化合物C2B中两种离子的半径大小关系为________ > ________(填离子符号)。_____________
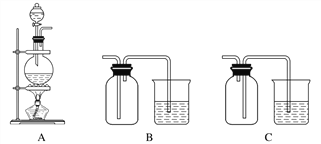
(3)实验室中欲选用下列装置制取并收集纯净干燥的E2气体。
实验中应选用的装置为( ) → ( ) → ( ) → ( ) (按由左到右的连接顺序填写);___________
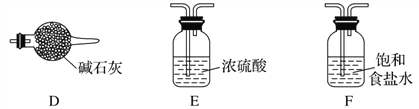
(4)试用电子式表示C2D的形成过程:___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语或模型正确的是( )
A.(CH3)3COH的名称:2,2二甲基乙醇
B.乙醛的结构式:CH3CHO
C.CH4分子的比例模型: ![]()
D.丙烯分子的结构简式为 CH3CHCH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),放入100mL浓度的H2SO4溶液中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀与加入NaOH溶液的体积的关系如右图所示,求:
(1)原溶液中c(H2SO4)= mol/L
(2)若a=2.3mL,计算各组分的质量:
m(Al2O3)= g;m(Fe2O3)= g;
(3)计算a值的取值范围: <a< .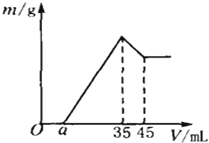
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com