
����Ŀ����1����������A, ���Է�������ͼ��ʾ��Ӧ������E��IΪ��ѧ��������ǿ�ᣬ��
![]()
��AΪ_____________��
��F![]() G�Ļ�ѧ����ʽΪ______________________��
G�Ļ�ѧ����ʽΪ______________________��
��Fe������I��ϡ��Һ��Ӧ�����ӷ���ʽ______________________________________��
����CO2�����л�������C������ȥCʱ�����ѡ��_______�Լ���
��2��Ǧ���仯������������ء������豸��X���߷������ϵȡ��ش��������⣺
�� Ǧ��̼��ͬ��Ԫ�أ���̼��4�����Ӳ㡣Ǧ��Ԫ�����ڱ���λ��Ϊ��_____���ڣ���____�壻
�� PbO2��Ũ���Ṳ�����ɻ���ɫ���壬��Ӧ�Ļ�ѧ����ʽΪ________________��
�� PbO2����PbO�����������Һ��Ӧ�Ƶã���Ӧ�����ӷ���ʽΪ______________��
�� PbO2�ڼ��ȹ��̷����ֽ��ʧ��������ͼ��ʾ����֪ʧ�������ϵ�a��Ϊ��Ʒʧ��4.0% (��![]() ���IJ������塣��a�������ɱ�ʾΪPbOx��mPbO2��nPbO������x��ֵ��m ��n��ֵx=_______��m ��n=________��
���IJ������塣��a�������ɱ�ʾΪPbOx��mPbO2��nPbO������x��ֵ��m ��n��ֵx=_______��m ��n=________��

���𰸡� (NH4)2S ![]() Fe+4H++NO3��=Fe3++NO��+2H2O ����NaHCO3 �� ��A PbO2+4HCl(Ũ)
Fe+4H++NO3��=Fe3++NO��+2H2O ����NaHCO3 �� ��A PbO2+4HCl(Ũ) ![]() PbCl2+Cl2��+2H2O PbO+ClO��=PbO2+Cl�� 1.4 2:3
PbCl2+Cl2��+2H2O PbO+ClO��=PbO2+Cl�� 1.4 2:3
��������(1). �ٳ�������������ˮ��Ӧ���ɵ�ǿ��Ϊ��������ᣬ��A�ֱ�����ͼӦ����S2-��NH3��AΪ(NH4)2S����F![]() GΪ��������������NO��ˮ������ʽΪ
GΪ��������������NO��ˮ������ʽΪ![]() ����ϡ�������ǿ�����ԣ�����ϡ���ᷴӦ����+3�������ӣ����ӷ���ʽΪ��Fe+4H++NO3��=Fe3++NO��+2H2O���ܶ�����̼�����ڱ���̼�����ƣ�SO2����֮��Ӧ�������Լ�ӦΪ����̼�����ƣ�
����ϡ�������ǿ�����ԣ�����ϡ���ᷴӦ����+3�������ӣ����ӷ���ʽΪ��Fe+4H++NO3��=Fe3++NO��+2H2O���ܶ�����̼�����ڱ���̼�����ƣ�SO2����֮��Ӧ�������Լ�ӦΪ����̼�����ƣ�
(2). ��Ǧ��̼ͬ���壬λ�ڵ������ڣ���A���壻�ڻ���ɫ����ΪCl2��Cl-��������Pb��+4�۱���ԭ������ʽΪ��PbO2+4HCl(Ũ) ![]() PbCl2+Cl2��+2H2O����PbO�����������Һ��Ӧ��Pb��+2�۱�������ClԪ�ر���ԭ������PbO2��Cl-�����ӷ���ʽΪ��PbO+ClO��=PbO2+Cl������PbO2�ڼ��ȹ��̷�����Ӧ�Ļ�ѧ����ʽΪPbO2
PbCl2+Cl2��+2H2O����PbO�����������Һ��Ӧ��Pb��+2�۱�������ClԪ�ر���ԭ������PbO2��Cl-�����ӷ���ʽΪ��PbO+ClO��=PbO2+Cl������PbO2�ڼ��ȹ��̷�����Ӧ�Ļ�ѧ����ʽΪPbO2![]() PbOx+
PbOx+ ![]() (2-x)O2�������跴Ӧ��PbO2Ϊ1mol������Ϊ239g����
(2-x)O2�������跴Ӧ��PbO2Ϊ1mol������Ϊ239g���� ![]() (2-x)��32=239��4.0%��x=1.4����ÿ1mol PbOx�к�1.4mol��ԭ�ӣ����ݻ�������ΪmPbO2 nPbO����(2m+n)=1.4�� (m+n) =1�����m=0.4��n=0.6����m:n=2/3��
(2-x)��32=239��4.0%��x=1.4����ÿ1mol PbOx�к�1.4mol��ԭ�ӣ����ݻ�������ΪmPbO2 nPbO����(2m+n)=1.4�� (m+n) =1�����m=0.4��n=0.6����m:n=2/3��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Z��һ�ֳ����İ뵼����ϣ�����Xͨ������ͼ��ʾ��·���Ʊ�������XΪZ�������YΪ�⻯����ӽṹ��������ƣ��ش��������⣺![]()
��1������X������ѧ��Ӧ������ ����X�Ʊ�Mg2Z�Ļ�ѧ����ʽΪ ��
��2����Mg2Z����Y�Ļ�ѧ��Ӧ����ʽΪ ��Y���ӵĵ���ʽΪ ��
��3��Z��X�й��ۼ������ͷֱ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ������Һ�У�Ͷ�벻���������ͭ����, ����˵����ȷ����
A.������״����B.�����ܽ⣬��Һ��Ũ�ȱ��
C.���岻�ܽ⣬��ҺŨ�Ȳ���D.������״�ı䣬��ҺŨ�Ȳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ǻϳ����ᡢ��κ͵��ʵĻ���ԭ�ϣ��ش��������⣺
��1������ˮ��Һ�������ԣ���ԭ��Ϊ �������ӷ���ʽ��ʾ����0.1mol/L�İ�ˮ�м���������NH4Cl���壬 ��Һ��pH������ߡ����͡�������������������������Һ�е�NH4+��Ũ������� ��С������
��2������識��ȷֽ�ɵõ�N2O��2H2O��250��ʱ����������ܱ������зֽ�ﵽƽ�⣬�÷ֽⷴӦ�Ļ�ѧ����ʽΪ �� ƽ�ⳣ������ʽΪ������1mol�������ȫ�ֽ⣬ת�Ƶĵ�����Ϊmol��
��3����N2O��H2O��Ӧ����N2��NO2�������仯��ͼ��ʾ��������1molN2 �� ���H= kJ/mol��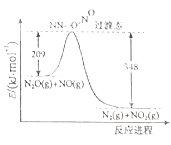
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ���������Ԫ��W��X��Y��Z��ԭ��������������W��X�ļ����Ӿ�����ͬ���Ӳ�ṹ��X��ԭ�Ӱ뾶�Ƕ���������Ԫ��ԭ�������ģ�W�� Yͬ����Z ��X �γɵ����ӻ������ˮ��Һ�����ԡ�����˵����ȷ����
A. �����Ӱ뾶��W<X<Z
B. W��X�γɵĻ���������ˮ����Һ�ʼ���
C. ��̬�⻯������ȶ��ԣ�W<Y
D. ����������ˮ��������ԣ�Y>Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������
��1��ij��ѧ�����о�С�飬���ʵ��̽��KI��Һ��FeCl3��Һ��Ӧ����һ�����ȣ��������ص�ʵ�鲽�������ѡ�Լ�����0.1molL��1KI��Һ����0.1molL��1 FeCl3��Һ����FeCl2��Һ���������KSCN��Һ����CCl4 ��
ʵ�鲽�裺��ȡ5mL 0.1molL��1 KI��Һ���ٵμ�5��6��0.1molL��1FeCl3��Һ
�ڳ�ַ�Ӧ����Һ�ֳ�����
��ȡ����һ�ݣ��μ��Լ�CCl4 �� ������һ��ʱ�䣬CCl4������Ϻ�ɫ��˵����Ӧ���ɵ⣮
����ȡһ�ݣ��μ��Լ������Լ���ţ���������Ϊ �� �÷�Ӧ��һ�����ȣ�
��2��Ϊ�Ƚ�Fe3+��Cu2+��H2O2�ֽ�Ĵ�Ч����ij��ѧ�о�С���ͬѧ�ֱ��������ͼ�ס�����ʾ��ʵ�飮��ش�������⣺ 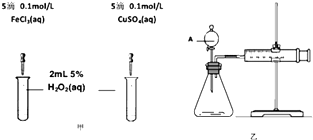
�ٶ��Է�������ͼ��ͨ���۲������������ԱȽϵó����ۣ���ͬѧ�����FeCl3��ΪFe2��SO4��3��Һ��Ϊ�������������� �� д��H2O2�ڶ������������·�����Ӧ�Ļ�ѧ����ʽ�� ��
�ڶ�����������ͼ����ʾ��ʵ��ʱ��������40mL����Ϊ����������Ӱ��ʵ������ؾ��Ѻ��ԣ�ʵ����һ����Ҫ������������������ţ���
���ռ�40mL��������Ҫ��ʱ�� ��CuSO4��Һ��FeCl3��Һ��Ũ�� �۹���������Һ��Ũ�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������Ҫ�ɷ֣�Fe3O4��Fe2O3��FeO���õ��̷�����FeSO47H2O������ͨ���̷��Ʊ�����[FeO��OH��]���������£����� ![]() ��Һ
��Һ ![]() �̷�
�̷� ![]() ���� ��֪��FeS2�����ƾ�������ˮ����˵������ȷ���ǣ�������
���� ��֪��FeS2�����ƾ�������ˮ����˵������ȷ���ǣ�������
A.����٣�������������ܽ�����
B.����ڣ��漰�����ӷ�ӦΪFeS2+14Fe3++8H2O�T15Fe2++2SO42��+16H+
C.����ۣ�����Һ���ȵ��н϶�����������������Ƚ�Һ�����ɣ��ɵô����̷�
D.����ܣ���Ӧ�������Ʋ�����ʹ�����л���Fe��OH��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ��ԭ�Ӱ뾶��ԭ�������Ĺ�ϵͼ��������˵����ȷ����
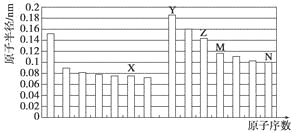
A. Z��N����Ԫ�ص����Ӱ뾶��ȣ�ǰ�߽ϴ�
B. X��N����Ԫ�ص���̬�⻯��ķе���ȣ�ǰ�߽ϵ�
C. ��X��M����Ԫ����ɵĻ����ﲻ�����κ��ᷴӦ��������ǿ�Ӧ
D. Z���������ֱܷ��ܽ���Y�����������N���⻯���ˮ��Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com