
【题目】按要求填空
(1)结构式如图所示,该化合物的系统命名为
![]()
(2)![]() 系统名称为 ;
系统名称为 ;
(3)某烃结构式如下:CH3﹣![]() ≡C﹣CH=CH﹣CH3,共面的碳原子最多有 个,共线的碳原子最多有 个.
≡C﹣CH=CH﹣CH3,共面的碳原子最多有 个,共线的碳原子最多有 个.
(4)键线式![]() 表示的分子式 .
表示的分子式 .
【答案】(1)2,3,5﹣三甲基已烷;
(2)2,3﹣二甲基﹣1﹣丁烯;
(3)12,6;
(4)C6H14;
【解析】
试题分析:(1)烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上碳原子编号,由简到繁同基合并,析出取代基名称和位置,最后写主链名称,据此分析;
(2)烯烃命名选取含碳碳双键在内的最长碳链为主链,从离双键近的一端给主链编号,写出取代基位置和名称,最后写出双键位置和主链烯烃名称;
(3)在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行共线、共面分析判断,注意单键可以旋转,根据其结构特点解答;
(4)依据碳原子写出四个共价键,氢原子形成一个共价键,短线表示的是碳碳原子形成的共价键,根据该有机物的键线式写出分子式;
解:(1)烷烃命名时,要选最长的碳链为主链,故主链上有6个碳原子,故为己烷,从离支链近的一端给主链上碳原子编号,故在2号、3号和5号碳原子上各有一个甲基,故名称为2,3,5﹣三甲基己烷,
故答案为:2,3,5﹣三甲基已烷;
(2)为烯烃,碳碳双键在1号C,含有碳碳双键的最长碳链含有4个C,主链为丁烯,选取含有支链最多的碳链为主链,名称为2,3﹣二甲基﹣1﹣丁烯,
故答案为:2,3﹣二甲基﹣1﹣丁烯;
(3)在CH3﹣![]() ﹣C≡C﹣CH=CH﹣CH3分子中,乙炔是直线型结构,C≡C三键形成的直线结构处于苯环平面内,苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,通过旋转连接C=C双键的C﹣C可能使甲基中碳原子处于C=C双键形成的平面,所以最多有12个C原子共面,即所有的碳原子都可能在同一平面内;分子中存在C≡C的直线结构,与﹣C≡C﹣相连的苯环中的碳原子、苯环上对位位置的碳原子、﹣CH3上的碳原子和与﹣C≡C﹣直接相连的C=C中的碳原子,共6个碳原子处于同一直线上,故在同一直线上的碳原子数为6,
﹣C≡C﹣CH=CH﹣CH3分子中,乙炔是直线型结构,C≡C三键形成的直线结构处于苯环平面内,苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,通过旋转连接C=C双键的C﹣C可能使甲基中碳原子处于C=C双键形成的平面,所以最多有12个C原子共面,即所有的碳原子都可能在同一平面内;分子中存在C≡C的直线结构,与﹣C≡C﹣相连的苯环中的碳原子、苯环上对位位置的碳原子、﹣CH3上的碳原子和与﹣C≡C﹣直接相连的C=C中的碳原子,共6个碳原子处于同一直线上,故在同一直线上的碳原子数为6,
故答案为:12,6;
(4)![]() 分子中含有6个碳原子,属于饱和烃,分子式为C6H14,故答案为:C6H14;
分子中含有6个碳原子,属于饱和烃,分子式为C6H14,故答案为:C6H14;


科目:高中化学 来源: 题型:
【题目】A、B、C是由周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如图1所示的关系,完成下列空白:
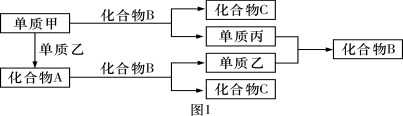
(1)向酚酞试液中加入化合物A的粉末,现象为 。
(2) 单质甲与化合物B反应的离子方程式为 。5.05 g单质甲—钾合金溶于200 mL水生成0.075 mol氢气,确定该合金的化学式为__ __。
(3)向20 mL某浓度的化合物C的溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1 mol/L盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图2图示两种情况。
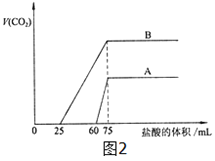
①由A确定滴加前60 mL的盐酸时,发生反应的离子方程式为 。
②由B表明,原溶液通入CO2气体后,所得溶液中的溶质的化学式为__ __。
③由A、B可知,两次实验通入的CO2的体积比为__ __。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种常见的强氧化剂。实验室以精选铬铁矿(主要成分可表示为FeO.Cr2O3,还含有SiO2、Al2O3等杂质)为原料制备重铬酸钾晶体(K2Cr2O7,式量294)的流程如下:

请回答下列问题:
(1)操作1中发生的反应有:
4FeO·Cr2O3 + 8Na2CO3 + 7O2 = 8Na2CrO4 + 2Fe2O3 + 8CO2↑
Na2CO3 + Al2O3 = 2NaAlO2 + CO2↑ Na2CO3 + SiO2 = Na2SiO3 + CO2↑
该步骤在常温下的反应速率较慢,为使反应速率增大,可采取的措施是_____________________,__________________________。(写出两条)
(2)固体Y中主要含有 ______________。(填写化学式)
(3)酸化步骤使含铬物质发生了转化为_________,请写出离子反应方程式____________。
(4)操作4中的化学反应在溶液中能发生的可能理由是_________________,获得晶体的操作依次是:加入KCl固体,在水浴上加热浓缩至____________________,冷却结晶,抽滤、洗涤、干燥。
(5)通过下列实验可测定产品中重铬酸钾的质量分数:
称取重铬酸钾试样1.470g,用100mL容量瓶配制成溶液。移取25.00mL溶液于碘量瓶中,加入适量稀硫酸和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入一定量的水,加入淀粉指示剂,用0.1500mol/L Na2S2O3标准溶液滴定,共消耗标准液36.00mL。滴定时发生的反应的离子方程式为:I2 + 2S2O32- = 2I- + S4O62-则所测定产品中重铬酸钾的纯度为___________。
(6)有关上述实验过程中涉及的部分实验操作的描述,正确的是____________。
A.粗产品若要进一步提纯,可以采用重结晶的方法
B.配制溶液时,用托盘天平称取试样后,一般经溶解、转移(含洗涤)、定容等步骤,配制成100mL溶液
C.滴定时,当最后一滴标准溶液滴入时,溶液变为蓝色,且半分钟内不变色,可判断滴定终点
D.滴定终点时俯视读数,测定结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到1 mol ·L-1 HC1溶液里,待合金完全溶解后,再往溶液里加入 1 mol L-1 NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如右图所示。下列说法中错误的是( )
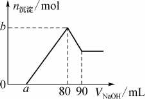
A.HC1溶液的体积为80 mL B.a的取值范围为0≤a<50
C.当a值为30时,b值为0.01 D.当a值为10时,b值为0.03
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于氧化还原反应的是( )
A.2 Al(OH)3![]() Al2O3+3 H2O
Al2O3+3 H2O
B.2H2O2![]() 2H2O+O2↑
2H2O+O2↑
C.FeO+2 HCl═FeCl2+H2O
D.FeCl2+2NaOH═Fe (OH)2↓+2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用一种试剂(可加热)就能将NH4C1、(NH4)2SO4、NaCl、Na2SO4四种溶液区分开,这种试剂是 ( )
A.NaOH溶液 B.AgNO3溶液 C.Ba(OH)2溶液 D.BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,7.8g Na2S和Na2O2的混合物中,阴离子所含电子数为1.8![]()
B.标准状况下,11.2LSO3中含有的分子数目为0.5 ![]()
C.常温常压下,46gNO2与 N2O4的混合气体含有的氮原子数目无法计算
D.0.1 mo1 L-1 MgC12溶液中含有的Mg2+数目小于0.1 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程合乎实际并用于工业生产的是( )
A. 钠在氯气中燃烧制氯化钠
B. 氯化铵与氢氧化钙共热制氨气
C. 浓盐酸与二氧化锰共热制氯气
D. 氯气与石灰乳反应制漂白粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达到平衡,平衡常数K=![]() .恒容时,温度升高,H2浓度减小.下列说法正确的是( )
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
A.该反应是焓变为正值
B.增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O![]() CO2+H2
CO2+H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com