
| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 向NaHCO3溶液中加入足量的Ba(OH)2溶液:Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O | |
| D. | 二氧化碳通入足量澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O |
分析 A.不符合反应客观事实;
B.漏掉氢离子与氢氧根离子的反应;
C.氢氧化钡过量反应生成碳酸钡、氢氧化钠和水;
D.氢氧化钙过量反应生成碳酸钙和水;
解答 解:A.铁和稀盐酸反应生成氯化亚铁和氢气,离子方程式:Fe+2H+═Fe2++H2↑,故A错误;
B.氢氧化钡溶液滴入硫酸中反应生成硫酸钡和水,离子方程式:Ba2++SO42-+2OH-+2H+═2H2O+BaSO4↓,故B错误;
C.向NaHCO3溶液中加入足量的Ba(OH)2溶液:Ba2++HCO3-+OH-=BaCO3↓+H2O,故C错误;
D.二氧化碳通入足量澄清石灰水中,离子方程式:CO2+Ca2++2OH-═CaCO3↓+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,侧重考查复分解反应离子方程式书写,明确相关物质的性质及发生反应实质是解题关键,注意反应物用量对反应的影响,注意离子反应遵循客观事实,题目难度不大.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:实验题
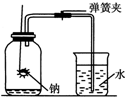 某班同学用如下图所示装置测定空气里氧气的含量.先用弹簧夹夹住橡胶管.点燃钠,伸入瓶中并塞上瓶塞.待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.
某班同学用如下图所示装置测定空气里氧气的含量.先用弹簧夹夹住橡胶管.点燃钠,伸入瓶中并塞上瓶塞.待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是一种验证某气体化学性质的实验装置,图中B为开关.如先打开B,在A处通入干燥氯气,C处红色布条颜色无变化;当关闭B,继续通入Cl2时,C处红色布条颜色褪去.则D瓶中盛有的溶液是( )
如图是一种验证某气体化学性质的实验装置,图中B为开关.如先打开B,在A处通入干燥氯气,C处红色布条颜色无变化;当关闭B,继续通入Cl2时,C处红色布条颜色褪去.则D瓶中盛有的溶液是( )| A. | 浓H2SO4 | B. | 饱和NaCl溶液 | C. | NaOH溶液 | D. | Ca (OH) 2悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、Na+、SO42- | B. | H+、Fe3+、Na+、NO3- | ||
| C. | Ba2+、K+、Al3+、HCO3- | D. | NH4+、Li+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
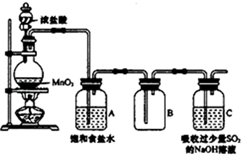 某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol/L H2SO4溶液至溶液呈酸性,然后将所得溶液分别置于A、B试管中 | / |
| 步骤2:向A试管中滴加1-2滴0.01mol/LKMnO4溶液 | Ⅰ:若溶液紫红色褪去,则假设1成立; Ⅱ:若溶液紫红色不褪去,则假设2或3成立, |
| 步骤3:向B试管中滴加1-2滴淀粉KI溶液 | Ⅰ:若溶液变蓝色,则假设1成立; Ⅱ:若溶液不变蓝色,结合步骤2中的II,假设3成立, |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若W是单质铁,则Z溶液可能是FeCl2溶液 | |
| B. | 若W是盐酸,则X与Z可反应生成Y | |
| C. | 若X是FeCl3溶液,则W可以是Zn或Al | |
| D. | 若W是硝酸溶液,则X与Z不能反应生成Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某溶液含有Na+、K+、①Cl-、②SO32-、③SO42-、④I-、⑤NO3-、⑥CO32-八种离子.向其中加入少量浓硝酸后,溶液中离子浓度基本保持不变的是(溶液体积变化忽略不计)( )
某溶液含有Na+、K+、①Cl-、②SO32-、③SO42-、④I-、⑤NO3-、⑥CO32-八种离子.向其中加入少量浓硝酸后,溶液中离子浓度基本保持不变的是(溶液体积变化忽略不计)( )| A. | ① | B. | ①③ | C. | ①③⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol•L-1HNO3溶液50mL | B. | 0.6mol•L-1A12(SO4)3溶液35 mL | ||
| C. | 1.8mol•L-1NaCl溶液70ml | D. | 0.7mol•L-1 FeC13溶液60 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com