
分析 物质导电的条件:含有自由电子或者自由移动的离子;在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不能导电的化合物是非电解质,注意单质、混合物都不是电解质,也不是非电解质,据此解答.
解答 解:H2SO4中不含有自由电子或者自由移动的离子,不导电;在水溶液能导电,属于电解质;
Cu含有自由电子电子,能够导电;但是属于单质,不是电解质;
Na2SO4中不含有自由电子或者自由移动的离子,不导电;在水溶液里或熔融状态下能导电的化合物是电解质;
C(石墨)含有自由电子电子,能够导电;属于单质,不是电解质;
C2H5OH(酒精)不含有自由电子或者自由移动的离子,不导电;在水溶液里和熔融状态下都不能导电是非电解质;
NaHSO4不含有自由电子或者自由移动的离子,不导电;在水溶液里或熔融状态下能导电的化合物是电解质;
NaCl不含有自由电子或者自由移动的离子,不导电;在水溶液里或熔融状态下能导电的化合物是电解质;
所以在常温下能导电的是:Cu、C(石墨);
属于电解质的是:H2SO4、Na2SO4、NaHSO4、NaCl;
故答案为:Cu、C(石墨);H2SO4、Na2SO4、NaHSO4、NaCl;
点评 本题考查了物质导电的条件、电解质的判断,明确电解质的概念是解题关键,注意单质、混合物都不是电解质,也不是非电解质.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.84 g NaHCO3晶体中阳离子和阴离子总数为0.03 NA | |
| B. | a g O2和O3的混合气体中所含分子数一定为$\frac{a}{32}$NA | |
| C. | 1.8 g H2O含有的质子数为NA | |
| D. | 标准状况下,2.24 L CCl4含碳原子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | t℃时,某溶液的pH=6,则该溶液一定为酸性 | |
| B. | 常温下,将pH=11的氨水稀释后,溶液中所有离子的浓度均降低 | |
| C. | 把1L 0.1mol/L醋酸溶液用蒸馏水稀释到10L,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的比值增大 | |
| D. | 常温下,硫酸铝在水溶液中的电离方程式为:Al2(SO4)3?2Al3++3SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
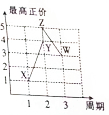 X、Y、Z、W、V是五种短周期主族元素,部分元素的周期序数与最高正价的关系如图所示.已知V元素的原子序数是下一周期同族元素的原子序数的一半.
X、Y、Z、W、V是五种短周期主族元素,部分元素的周期序数与最高正价的关系如图所示.已知V元素的原子序数是下一周期同族元素的原子序数的一半. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.40 | 0.35 | 0.31 | 0.3 | 0.3 | 0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
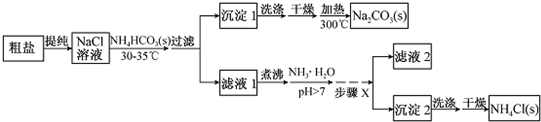
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18O原子所含中子数为8 | |
| B. | 1mol的1H218O分子所含质子数为12个 | |
| C. | 18O2气体的摩尔体积为22.4L/mol | |
| D. | 18O2气体的摩尔质量为36g/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com