
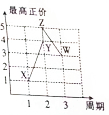
 X、Y、Z、W、V是五种短周期主族元素,部分元素的周期序数与最高正价的关系如图所示.已知V元素的原子序数是下一周期同族元素的原子序数的一半.
X、Y、Z、W、V是五种短周期主族元素,部分元素的周期序数与最高正价的关系如图所示.已知V元素的原子序数是下一周期同族元素的原子序数的一半. 分析 X、Y、Z、W、V是五种短周期主族元素,V元素的原子序数是下一周期同族元素的原子序数的一半,则V是O元素;部分元素的周期序数与最高正价的关系如图所示,X、Y、Z、W元素最高价分别为1、4、5、3,根据元素所在周期知,X是H元素、Y是C元素、Z是N元素、W是Al元素,
(1)主族元素原子核外电子层数与其周期数相等,最外层电子数与其族序数相等;
(2)由上述元素中所有非金属元素组成且既含离子键又含共价键的化合物有硝酸铵、乙酸铵;由上述元素中所有非金属元素组成且只含共价键的物质中有硝基苯及其同系物、油脂等;
(3)Al(CH3)3与N的简单氢化物氨气共热可制得AlN,根据反应物和生成物及反应条件书写方程式;
(4)由上述元素中的两种元素组成的某化合物N中含有18个电子,该物质的水溶液是一种常见的消毒剂,N是双氧水;①双氧水分解时双氧水既是氧化剂又是还原剂;
②酸化的N溶液可使淀粉-KI试纸变蓝,双氧水能氧化碘离子生成碘单质;
③双氧水能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色.
解答 解:X、Y、Z、W、V是五种短周期主族元素,V元素的原子序数是下一周期同族元素的原子序数的一半,则V是O元素;部分元素的周期序数与最高正价的关系如图所示,X、Y、Z、W元素最高价分别为1、4、5、3,根据元素所在周期知,X是H元素、Y是C元素、Z是N元素、W是Al元素,
(1)主族元素原子核外电子层数与其周期数相等,最外层电子数与其族序数相等,O原子核外有2个电子层、最外层电子数为6,所以位于第二周期第VIA族,故答案为:VIA;
(2)由上述元素中所有非金属元素组成且既含离子键又含共价键的化合物有硝酸铵、乙酸铵,化学式为NH4NO3、CH3COO(NH4)2;由上述元素中所有非金属元素组成且只含共价键的物质中有硝基苯及其同系物、油脂等,故答案为:NH4NO3、CH3COO(NH4)2;BC;
(3)Al(CH3)3与N的简单氢化物氨气共热可制得AlN,根据反应物和生成物及反应条件书写方程式为,故答案为:Al(CH3)3+NH3$\frac{\underline{\;\;△\;\;}}{\;}$AlN+3CH4,
故答案为:Al(CH3)3+NH3$\frac{\underline{\;\;△\;\;}}{\;}$AlN+3CH4;
(4)由上述元素中的两种元素组成的某化合物N中含有18个电子,该物质的水溶液是一种常见的消毒剂,N是双氧水;①双氧水分解时双氧水既是氧化剂又是还原剂,反应方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
②酸化的N溶液可使淀粉-KI试纸变蓝,双氧水能氧化碘离子生成碘单质,离子反应方程式为2H++H2O2+2I-=I2+2H2O,故答案为:2H++H2O2+2I-=I2+2H2O;
③双氧水能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,离子方程式为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
故答案为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑.
点评 本题考查位置结构性质相互关系及应用,为高频考点,正确判断元素是解本题关键,熟悉常见元素化合物性质,会根据双氧水中O元素化合价确定双氧水性质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 100mL 0.5mol/L MgCl2溶液 | B. | 200mL 0.25mol/L CaCl2溶液 | ||
| C. | 50mL 1mol/L NaCl溶液 | D. | 250mL 0.2mol/L HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; 、
、 ,且苯环上有两个对位取代基的结构简式是
,且苯环上有两个对位取代基的结构简式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在500℃下,向某恒容密闭容器中投入amolA2和bmolB2发生可逆反应A2(g)+B2(g)?2AB(g),△H>0,AB的物质的量与时间关系如图所示:
在500℃下,向某恒容密闭容器中投入amolA2和bmolB2发生可逆反应A2(g)+B2(g)?2AB(g),△H>0,AB的物质的量与时间关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | a | b |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 药品名称 | 熔点/℃ | 沸点(℃) | 密度g/cm3 | 溶解性 |
| 丁醇 | -89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下6.72L NH3的质量约为5.1g | |
| B. | 10g D216O分子中所含中子数为4NA | |
| C. | 2.3g金属钠全部变成钠离子失去的电子数目为0.2NA | |
| D. | 150mL1mol/L氯化钠溶液与50mL1mol/L AlCl3溶液中氯离子的物质的量浓度相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com