
| 药品名称 | 熔点/℃ | 沸点(℃) | 密度g/cm3 | 溶解性 |
| 丁醇 | -89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |

分析 (1)反应装置中加入的固体M是沸石,目的是防止暴沸;用量筒量取相同量的硫酸和水再烧杯中进行混合;
(2)冷凝管是下管进水,上管出水,有利于冷却;
(3)根据图1中最后的收集装置是防倒吸装置来解答;
(4)若用浓硫酸进行实验,由于浓硫酸具有强氧化性会使部分溴离子氧化为溴单质;
a.蒸馏也会使部分原料物挥发出来;
b.氢氧化钠溶液洗涤,会使卤代烃发生水解,主成分减少;
c.用四氯化碳无法萃取,由于溴和卤代烃都能溶于四氯化碳;
d.用亚硫酸钠溶液洗涤可和溴发生氧化还原反应,再通过分液操作即可分离;
(5)根据表中1-溴丁烷的沸点可知收集产品时,控制的温度应在101.6℃左右;
(6)原料正丁醇的质量为lOmL×0.8098g/cm3=8.098g,由-溴丁烷的质量为10.895g,根据方程式NaBr+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O求出参加反应的正丁醇的质量,再用此质量除以原料正丁醇的质量即得转化率.
解答 解:(1)反应装置中加入沸石的目的是防止暴沸;用量筒量取相同量的硫酸和水进行混合,故定量仪器为量筒;
故答案为:防止液体暴沸;bcd;
(2)冷凝管是下管进水,上管出水,这样冷却充分,冷凝效果好;
故答案为:下进上出; 能更充分冷凝;
(3)图1中最后的收集装置是防倒吸装置,ABD装置也可用于防倒吸;
故答案为:ABD;
(4)若用浓硫酸进行实验,由于浓硫酸具有强氧化性会使部分溴离子氧化为溴单质;
a.蒸馏也会使部分原料物挥发出来,无法除去其中杂质,故a错误;
b.氢氧化钠溶液洗涤,会使卤代烃发生水解,造成损失,故b错误;
c.由于溴和卤代烃都能溶于四氯化碳,用四氯化碳无法萃取,故c错误;
d.用亚硫酸钠溶液洗涤可和溴发生氧化还原反应,再通过分液操作即可分离,故d正确;
故答案为:d;
(5)根据表中1-溴丁烷的沸点可知收集产品时,控制的温度应在101.6℃左右;
故答案为:101.6;
(6)原料正丁醇的质量为lOmL×0.8098g/cm3=8.098g,参加反应的正丁醇的质量为m,
Br+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O
74 137
m 10.895g
$\frac{74}{m}$=$\frac{137}{10.895g}$ 解得:m=5.8849g
正丁醇的转化率为$\frac{5.8849g}{8.098g}$×100=72.7%;
故答案为:72.7%.
点评 本题以1-溴丁烷制备为背景,综合考查了物质的分离方法、实验装置、冷凝方法、转化率等,充分考查了学生分析、理解能力及解决实际问题的能力,本题难度中等.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | O2和O3 | B. | H2和D2 | C. | ${\;}_{1}^{1}$H和${\;}_{1}^{2}$H | D. | CH4 和C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
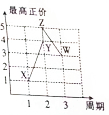 X、Y、Z、W、V是五种短周期主族元素,部分元素的周期序数与最高正价的关系如图所示.已知V元素的原子序数是下一周期同族元素的原子序数的一半.
X、Y、Z、W、V是五种短周期主族元素,部分元素的周期序数与最高正价的关系如图所示.已知V元素的原子序数是下一周期同族元素的原子序数的一半. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜与硝酸银溶液反应 Cu+Ag+═Cu2++Ag | |
| B. | CH3COOH溶液与NaOH溶液反应 H++OH-═H2O | |
| C. | 碳酸镁与稀H2SO4反应 MgCO3+2H+═Mg2++H2O+CO2↑ | |
| D. | 石灰乳与稀盐酸反应 H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、SO42-、HCO3-? | B. | Mg2+、K+、SO42-、OH- | ||
| C. | K+、Na+、Fe3+、NO3- | D. | Ba2+、OH-、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com