

 (或写成
(或写成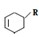 R代表取代基或氢);Ⅱ.甲为烃;Ⅲ.F能与NaHCO3反应产生CO2;请完成以下问题:
R代表取代基或氢);Ⅱ.甲为烃;Ⅲ.F能与NaHCO3反应产生CO2;请完成以下问题:
 ;
; ,结合题给信息知,Z和甲发生加成反应生成W,所以甲的结构简式为:
,结合题给信息知,Z和甲发生加成反应生成W,所以甲的结构简式为: ,甲和Z发生加成反应生成W,W的结构简式为:
,甲和Z发生加成反应生成W,W的结构简式为: ,1,4-二甲苯被酸性高锰酸钾氧化生成F1,4-二苯甲酸,1,4-二苯甲酸和
,1,4-二甲苯被酸性高锰酸钾氧化生成F1,4-二苯甲酸,1,4-二苯甲酸和 发生酯化反应生成H,则H的结构简式为:
发生酯化反应生成H,则H的结构简式为: .
. ;
; ,结合题给信息知,Z和甲发生加成反应生成W,所以甲的结构简式为:
,结合题给信息知,Z和甲发生加成反应生成W,所以甲的结构简式为: ,甲和Z发生加成反应生成W,W的结构简式为:
,甲和Z发生加成反应生成W,W的结构简式为: ,1,4-二甲苯被酸性高锰酸钾氧化生成F1,4-二苯甲酸,1,4-二苯甲酸和
,1,4-二甲苯被酸性高锰酸钾氧化生成F1,4-二苯甲酸,1,4-二苯甲酸和 发生酯化反应生成H,则H的结构简式为:
发生酯化反应生成H,则H的结构简式为:
 ;E发生加聚反应,方程式为
;E发生加聚反应,方程式为 ;Z的结构简式为:HOCCH=CHCHO,Z和甲反应生成W,W和氢气发生加成反应生成
;Z的结构简式为:HOCCH=CHCHO,Z和甲反应生成W,W和氢气发生加成反应生成 ,结合题给信息知,Z和甲发生加成反应生成W,所以甲的结构简式为:
,结合题给信息知,Z和甲发生加成反应生成W,所以甲的结构简式为: ,甲和Z发生加成反应生成W,W的结构简式为:
,甲和Z发生加成反应生成W,W的结构简式为: ,
, →
→ ,
,

 →
→
 ,
, .
.


科目:高中化学 来源: 题型:
| A、若甲苯苯环上的一个氢原子被一个含3个碳原子的烷基取代,所得产物有6种 |
B、与 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 |
| C、含有5个碳原子的饱和链烃,其一氯取代物共有8种 |
D、菲的结构简式为 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ④ |
| ② |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com