

| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |

| 1.28mol |
| 4mol |
| 8.961L |
| 5 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、含1mol NH3?H2O |
| B、含NH3、NH4+之和为1mol |
| C、只含有1mol NH3 |
| D、NH3、NH3?H2O、NH4+之和为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| B、往CaCl2溶液通入少量的CO2:Ca2++CO2+H2O═CaCO3↓+2H+ |
| C、碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O |
| D、向Ba(OH)2溶液中加入少量的NaHSO3溶液:HSO3-+Ba2++OH-═BaSO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
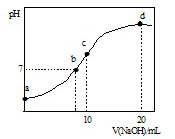 常温下,向20.00mL 0.1000mol?L-1 (NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如右图所示(不考虑挥发).下列说法正确的是 ( )
常温下,向20.00mL 0.1000mol?L-1 (NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如右图所示(不考虑挥发).下列说法正确的是 ( )| A、点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+) |
| B、点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C、点c所示溶液中:c(SO42-)+c(H+)=c(NH3?H2O )+c(OH-) |
| D、点d所示溶液中:c(SO42-)>c(NH3?H2O )>c(OH-)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

 (或写成
(或写成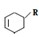 R代表取代基或氢);Ⅱ.甲为烃;Ⅲ.F能与NaHCO3反应产生CO2;请完成以下问题:
R代表取代基或氢);Ⅱ.甲为烃;Ⅲ.F能与NaHCO3反应产生CO2;请完成以下问题:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 序号 |
铁的质量/g | 铁的 形态 |
V(H2SO4) /mL |
c(H2SO4) /mol?L-1 |
反应前溶液 的温度/℃ |
金属完全消 失的时间/s |
| 1 | 0.10 | 片状 | 50 | 0.8 | 20 | 200 |
| 2 | 0.10 | 粉状 | 50 | 0.8 | 20 | 25 |
| 3 | 0.10 | 片状 | 50 | 1.0 | 20 | 125 |
| 4 | 0.10 | 片状 | 50 | 1.0 | 35 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
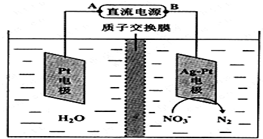 化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染.电化学降解NO3-的原理如图所示.
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染.电化学降解NO3-的原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com