
A、 证明非金属性强弱:S>C>Si |
B、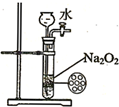 制备少量氧气 |
C、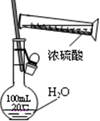 配制一定物质的量浓度的硫酸溶液 |
D、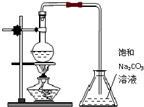 制备少量乙酸丁酯 |


科目:高中化学 来源: 题型:
A、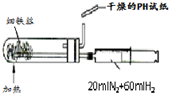 合成氨并检验氨的生成 |
B、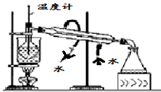 碘的CCl4溶液中分离I2并回收CCl4 |
C、 分离CH3CH2OH和CH3COOC2H5混合液 |
D、 制备Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )| A、MgSO4,CuSO4 |
| B、AgNO3,Pb(NO3)2 |
| C、FeSO4,Al2 (SO4)3 |
| D、CuSO4,AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 |
IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com