
 如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )| A、MgSO4,CuSO4 |
| B、AgNO3,Pb(NO3)2 |
| C、FeSO4,Al2 (SO4)3 |
| D、CuSO4,AgNO3 |


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
| A、用相同浓度的HNO3溶液中和,硝酸体积小于氨水时,溶液可能呈中性 |
| B、温度不变,加水稀释后溶液中c(NH4+)?c(OH-)不变 |
| C、加水稀释后,溶液中导电粒子的数目减少 |
| D、其溶液的pH=13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| B、往CaCl2溶液通入少量的CO2:Ca2++CO2+H2O═CaCO3↓+2H+ |
| C、碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O |
| D、向Ba(OH)2溶液中加入少量的NaHSO3溶液:HSO3-+Ba2++OH-═BaSO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、当有0.2 mol电子转移时,a电极产生2.24 L H2 |
| B、b电极上发生的电极反应式为2H++2e-═H2↑ |
| C、d电极上发生的电极反应式为O2+4H++4e-═2H2O |
| D、d电极上进行氧化反应,B池中的H+可以通过隔膜进入A池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
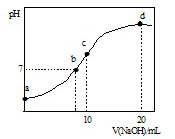 常温下,向20.00mL 0.1000mol?L-1 (NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如右图所示(不考虑挥发).下列说法正确的是 ( )
常温下,向20.00mL 0.1000mol?L-1 (NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如右图所示(不考虑挥发).下列说法正确的是 ( )| A、点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+) |
| B、点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C、点c所示溶液中:c(SO42-)+c(H+)=c(NH3?H2O )+c(OH-) |
| D、点d所示溶液中:c(SO42-)>c(NH3?H2O )>c(OH-)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 序号 |
铁的质量/g | 铁的 形态 |
V(H2SO4) /mL |
c(H2SO4) /mol?L-1 |
反应前溶液 的温度/℃ |
金属完全消 失的时间/s |
| 1 | 0.10 | 片状 | 50 | 0.8 | 20 | 200 |
| 2 | 0.10 | 粉状 | 50 | 0.8 | 20 | 25 |
| 3 | 0.10 | 片状 | 50 | 1.0 | 20 | 125 |
| 4 | 0.10 | 片状 | 50 | 1.0 | 35 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
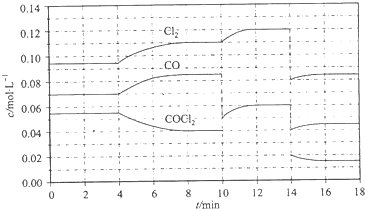 光气 (COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.
光气 (COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com