
| A、含1mol NH3?H2O |
| B、含NH3、NH4+之和为1mol |
| C、只含有1mol NH3 |
| D、NH3、NH3?H2O、NH4+之和为1mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该装置能将电能转化为化学能 |
| B、活性炭为正极,其电极反应式为:2H++2e-═H2↑ |
| C、电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔 |
| D、装置内总反应方程式为:4Al+3O2+6H2O═4Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若甲苯苯环上的一个氢原子被一个含3个碳原子的烷基取代,所得产物有6种 |
B、与 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 |
| C、含有5个碳原子的饱和链烃,其一氯取代物共有8种 |
D、菲的结构简式为 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+ClO-═SO42-+Cl-+H+ |
| B、小苏打溶液与偏铝酸钠溶液混合:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- |
| C、“84”消毒液(主要成分为NaClO)露置在空气中变质:2ClO-+CO2+H2O═CO32-+2HClO |
| D、在“84”消毒液中滴加FeSO4溶液:2Fe2++ClO-+H2O═2Fe3++Cl-+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、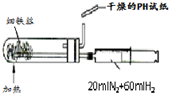 合成氨并检验氨的生成 |
B、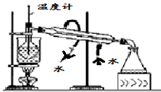 碘的CCl4溶液中分离I2并回收CCl4 |
C、 分离CH3CH2OH和CH3COOC2H5混合液 |
D、 制备Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com