
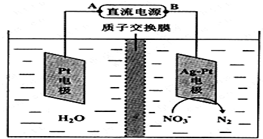
 化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染.电化学降解NO3-的原理如图所示.
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染.电化学降解NO3-的原理如图所示.

科目:高中化学 来源: 题型:
A、 合成氨并检验氨的生成 |
B、 碘的CCl4溶液中分离I2并回收CCl4 |
C、 分离CH3CH2OH和CH3COOC2H5混合液 |
D、 制备Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

 )在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式:
)在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 石棉矿是天然纤维状硅酸盐类矿物的总称,可分为蛇纹石石棉矿(又称温石棉矿)和闪石类石棉矿两大类.蛇纹石石棉矿具有优良的性能,在工业中应用广泛,在国防和航天工业中亦有许多用途.
石棉矿是天然纤维状硅酸盐类矿物的总称,可分为蛇纹石石棉矿(又称温石棉矿)和闪石类石棉矿两大类.蛇纹石石棉矿具有优良的性能,在工业中应用广泛,在国防和航天工业中亦有许多用途.查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 |
IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液的水解:CO32-+H3O+?HCO3-+H2O |
| B、钢铁吸氧腐蚀时,负极反应式为:4OH--4e-═2H2O+O2↑ |
| C、向Al2(SO4)3溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀:2Al3++3SO42-+8OH-+3Ba2+═2AlO2-+3BaSO4↓+4H2O |
| D、氯化亚铁溶液中滴入稀硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com