

 ����һ�������¿����ɷ������̼������д����Ӧ�Ļ�ѧ����ʽ��
����һ�������¿����ɷ������̼������д����Ӧ�Ļ�ѧ����ʽ��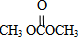 ����X��OHCH2CH2OH����Ȼ�����л���Ľṹ�����������
����X��OHCH2CH2OH����Ȼ�����л���Ľṹ�����������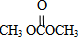 ����X��OHCH2CH2OH����
����X��OHCH2CH2OH����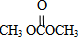 ��XΪOHCH2CH2OH���ʴ�Ϊ��
��XΪOHCH2CH2OH���ʴ�Ϊ��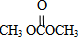 ��OHCH2CH2OH��
��OHCH2CH2OH�� ����һ�������¿����ɷ������̼��������Ӧ�Ļ�ѧ����ʽΪ2n
����һ�������¿����ɷ������̼��������Ӧ�Ļ�ѧ����ʽΪ2n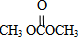 +n
+n ��
��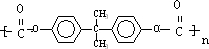 +4nCH3OH���ʴ�Ϊ��2n
+4nCH3OH���ʴ�Ϊ��2n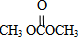 +n
+n ��
�� +4nCH3OH��
+4nCH3OH��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ͬŨ�ȵ�HNO3��Һ�кͣ��������С�ڰ�ˮʱ����Һ���ܳ����� |
| B���¶Ȳ��䣬��ˮϡ�ͺ���Һ��c��NH4+��?c��OH-������ |
| C����ˮϡ�ͺ���Һ�е������ӵ���Ŀ���� |
| D������Һ��pH=13 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
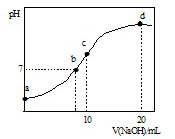 �����£���20.00mL 0.1000mol?L-1 ��NH4��2SO4��Һ����μ���0.2000mol?L-1 NaOHʱ����Һ��pH������NaOH��Һ����Ĺ�ϵ����ͼ��ʾ�������ǻӷ���������˵����ȷ���� ��������
�����£���20.00mL 0.1000mol?L-1 ��NH4��2SO4��Һ����μ���0.2000mol?L-1 NaOHʱ����Һ��pH������NaOH��Һ����Ĺ�ϵ����ͼ��ʾ�������ǻӷ���������˵����ȷ���� ��������| A����a��ʾ��Һ�У�c��NH4+����c��SO42-����c��OH-����c��H+�� |
| B����b��ʾ��Һ�У�c��NH4+��=c��Na+����c��H+��=c��OH-�� |
| C����c��ʾ��Һ�У�c��SO42-��+c��H+��=c��NH3?H2O ��+c��OH-�� |
| D����d��ʾ��Һ�У�c��SO42-����c��NH3?H2O ����c��OH-����c��NH4+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ�� ��� |
��������/g | ���� ��̬ |
V��H2SO4�� /mL |
c��H2SO4�� /mol?L-1 |
��Ӧǰ��Һ ���¶�/�� |
������ȫ�� ʧ��ʱ��/s |
| 1 | 0.10 | Ƭ״ | 50 | 0.8 | 20 | 200 |
| 2 | 0.10 | ��״ | 50 | 0.8 | 20 | 25 |
| 3 | 0.10 | Ƭ״ | 50 | 1.0 | 20 | 125 |
| 4 | 0.10 | Ƭ״ | 50 | 1.0 | 35 | 50 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
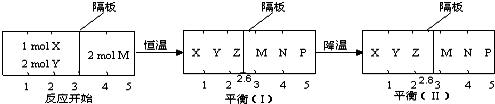
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
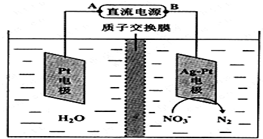 ��ѧ�ڻ�������������ʮ����Ҫ�����ã��绯ѧ���ⷨ��������������ˮ�е���������Ⱦ���绯ѧ����NO3-��ԭ����ͼ��ʾ��
��ѧ�ڻ�������������ʮ����Ҫ�����ã��绯ѧ���ⷨ��������������ˮ�е���������Ⱦ���绯ѧ����NO3-��ԭ����ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | t |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
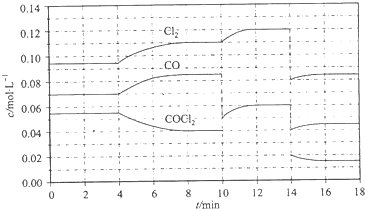 ���� ��COCl2�������ϡ��Ƹ��ҩ�ȹ�ҵ����������;����ҵ�ϲ��ø�����CO��Cl2�ڻ���̿���ºϳɣ�
���� ��COCl2�������ϡ��Ƹ��ҩ�ȹ�ҵ����������;����ҵ�ϲ��ø�����CO��Cl2�ڻ���̿���ºϳɣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6��10-5 | 6.3��10-9 | 1.6��10-9 | 4.2��10-10 |
| A���ڱ�����������ĵ��뷽��ʽΪH2SO4��2H++SO42- |
| B���ڱ������и�������������������ǿ���� |
| C���ڱ��������������ᶼû����ȫ���� |
| D������ʵ�ǿ�����������ܼ���� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com