
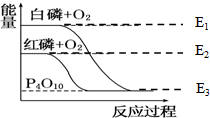
 白磷和红磷与氧气反应过程与能量的变化关系如图,E表示能量(单位kJ/mol),则下列说法正确的是( )
白磷和红磷与氧气反应过程与能量的变化关系如图,E表示能量(单位kJ/mol),则下列说法正确的是( )| A、白磷比红磷稳定 |
| B、红磷转变为白磷是吸热反应 |
| C、白磷燃烧是吸热反应 |
| D、红磷燃烧的热化学方程式可表达为:4P(s)+5O2(g)=P4O10(s),△H=-(E3-E2) kJ/mol |


科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、485.5 kJ/mol |
| B、610 kJ/mol |
| C、917 kJ/mol |
| D、1 220 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol硫酸钾中阴离子所带电荷数为NA |
| B、常温下,2.7克铝与足量的稀硫酸反应,失去的电子数为0.1NA |
| C、在常温下,把100 g CaCO3加到1 L水中,所得溶液中的Ca2+ 数等于NA |
| D、在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、适量的稀硫酸 |
| B、适量的NaCl溶液 |
| C、适量的氨水 |
| D、适量的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应式为Pb-2e-+SO42-=PbSO4 |
| B、充放电时,溶液的导电能力变化不大 |
| C、以该电池电解NaCl溶液时,当消耗207gPb时,在阳极生成Cl222.4L |
| D、充电时的阳极反应式为Pb 2++2e-+4OH-=PbO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
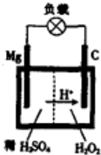 1808年,英国化学家用钾还原氧化镁,最早制得少量的镁.镁是航空工业的重要材料,镁作为一种强氧化剂,还用于钛、铍和铀的生产中.
1808年,英国化学家用钾还原氧化镁,最早制得少量的镁.镁是航空工业的重要材料,镁作为一种强氧化剂,还用于钛、铍和铀的生产中.查看答案和解析>>
科目:高中化学 来源: 题型:
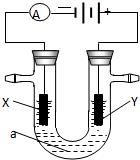 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com