
【题目】某有机化合物A的相对分子质量范围为100~130.经分析得知,其中碳和氢的质量分数之和为46.66%,其余为氧,则该化合物分子中最多含碳氧双键的个数为( )
A.1
B.2
C.3
D.4
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:①电解池中X极上的电极反应式为;在X极附近观察到的现象是 .
②Y电极上的电极反应式为;检验该电极反应产物的方法是 .
(2)如用电解方法精炼粗铜,电解液a选用CuSO4溶液,则①X电极的材料是 , 电极反应式为 .
②Y电极的材料是 , 电极反应式为 . (说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以由下列反应合成三聚氰胺:CaO+3C ![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2 ![]() CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2 , NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.
CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2 , NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.
(1)写出与Ca在同一周期且最外层电子数为1、内层电子全排满的基态原子的核外电子排布式: .
(2)CaCN2中阴离子为CN ![]() ,与CN
,与CN ![]() 互为等电子体的分子有N2O和(填化学式),由此可以推知CN
互为等电子体的分子有N2O和(填化学式),由此可以推知CN ![]() 的空间构型为 .
的空间构型为 .
(3)尿素分子中C原子采取杂化.尿素分子的结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O,Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
2Pb(BF4)2+2H2O,Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A. 放电时,负极反应为:PbO2+4HBF4-2e-=Pb(BF4)2+2BF4-+2H2O
B. 充电时,当正极质量减少23.9g时转移0.2mol电子
C. 放电时,PbO2电极附近溶液的pH增大
D. 充电时,Pb电极的电极反应式为PbO2+4H++2e-=Pb2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为CH4燃料电池的装置(A、B为多孔碳棒):
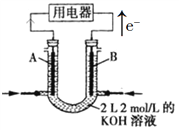
(1)_____(填A或B)处电极入口通甲烷,其电极反应式为_____________。
(2)当消耗甲烷的体积为11.2 L(标准状况下)时,消耗KOH的质量为_______g。
(3)铅蓄电池是最早使用的充电电池,由Pb、PbO2、硫酸构成。该电池工作时,正极的电极反应式为____________________。
(4)500 mL KNO3和Cu(NO3)2的混合溶液中c(![]() )=6.0 mol·L1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL。原混合溶液中c(K+)为_________mol·L1。
)=6.0 mol·L1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL。原混合溶液中c(K+)为_________mol·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如图所示. 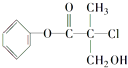
由A的结构推测,它能(填字母).
a.使溴的四氯化碳溶液褪色
b.使酸性KMnO4溶液褪色
c.和稀硫酸混合加热,可以发生取代反应
d.与Na2CO3溶液作用生成CO2
e.1mol A和足量的NaOH溶液反应,最多可以消耗3mol NaOH
f.和NaOH醇溶液混合加热,可以发生消去反应
g.1mol A和足量的H2反应,最多可以消耗4mol H2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁分析中常用高氯酸(HClO4)溶解矿样,某研究性学习小组欲制取少量高氯酸。该学习小组查阅到:
a.HClO4浓度高于60%时遇含碳化合物易爆炸,浓度低于60%时比较稳定;
b.NaClO4与浓硫酸反应可制得高氯酸,若采用真空蒸馏可得纯高氯酸;
c.NaClO3在673K(400℃) 分解产生NaClO4、NaCl和一种气体。
该小组同学设计实验分三步制备高氯酸:
(一)制氯气并使制得的氯气与氢氧化纳溶液反应制氯酸纳;
(二)氯酸钠分解制高氯酸钠;
(三)高氯酸纳与浓硫酸反应制高氯酸[2NaClO4+H2SO4(浓)![]() Na2SO4+2HClO4]。
Na2SO4+2HClO4]。
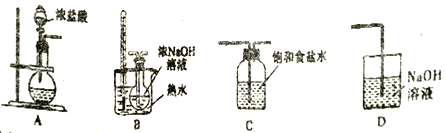
(1)制取氯酸钠的装置连接顺序为A,___________
(2)B 装置中发生反应的离子方程式为__________________________。
(3)为了制备高氯酸钠并推出氯酸钠分解制高氯酸钠的化学方程式,该小组设计了两组装置(甲,乙)如下:
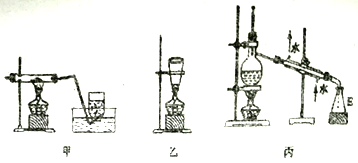
该小组经过分析决定选用甲装置制备高氯酸钠,取NaClO3样品2.13 g,加热充分反应后集气瓶中收集到224 mL (标准状况下)气体,则该反应的化学方程式为_________________________;不选用乙装置的原因可能为______________________。
(4)用丙裝置制备高氯酸,向烧瓶中加入高氯酸钠,然后加入浓硫酸后,加热可制取高氯酸。实验开始前,胶塞及导管接口需要包锡箔纸,其原因是___________,仪器E的名称为___________。该组同学发现操作中少加入一种物质,该物质的名称为___________。发现后的正确操作为_________________。
(5)工业上大量制备NaClO4常用高电流密度电解NaClO3的方法,试写出以惰性电极电解时的阳极反应式:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应:xR2++Cl2=yR3++zCl-的说法中正确的是
A. x=y,R2+得到电子 B. x=2, Cl2作氧化剂
C. y=z,R3+是还原产物 D. x=z, Cl-是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含A元素的一种单质是一种重要的半导体材料,含 A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)A的原子结构示意图为________,A与碳在原子的电子层结构上的相同点是________________________________________________________。
(2)易与C发生化学反应的酸是_________(写名称),反应的化学方程式是_______________________________。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D
①写出该反应的化学方程式:___________________________________________。
②要将纯碱高温熔化,下列坩埚中可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.铁坩埚
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com