
����Ŀ��ij�л���A��ũҩ�����е�һ���м��壬��ṹ��ʽ��ͼ��ʾ�� 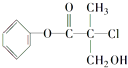
��A�Ľṹ�Ʋ⣬����������ĸ����
a��ʹ������Ȼ�̼��Һ��ɫ
b��ʹ����KMnO4��Һ��ɫ
c����ϡ�����ϼ��ȣ����Է���ȡ����Ӧ
d����Na2CO3��Һ��������CO2
e��1mol A��������NaOH��Һ��Ӧ������������3mol NaOH
f����NaOH����Һ��ϼ��ȣ����Է�����ȥ��Ӧ
g��1mol A��������H2��Ӧ������������4mol H2 ��
���𰸡�bcef
���������⣺�ɽṹ��֪�������к���Cl����OH����COOC����
a�������岻��Ӧ������ʹ������Ȼ�̼��Һ��ɫ���ʴ���
b������OH����ʹ����KMnO4��Һ��ɫ������ȷ��
c������COOC������ϡ�����ϼ��ȣ����Է���ȡ����Ӧ��ˮ�ⷴӦ��������ȷ��
d��������COOH��������Na2CO3��Һ��������CO2 �� �ʴ���
e����Cl����COOC����ˮ�����ɵķө�OH����NaOH��Ӧ����1mol A��������NaOH��Һ��Ӧ������������3mol NaOH������ȷ��
f������Cl����NaOH����Һ��ϼ��ȣ����Է�����ȥ��Ӧ������ȷ��
g��ֻ�б��������������ӳɷ�Ӧ����1mol A��������H2��Ӧ������������3mol H2 �� �ʴ���
���Դ��ǣ�bcef��
�����㾫����������Ĺؼ����������л���Ľṹ�����ʵ����֪ʶ�������л���������ص㣺������ˮ�����������͡��ƾ��������л��ܼ�����Ϊ�ǵ���ʣ������磻�����۷е�ϵͣ�������ȼ�գ��ֽ⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ļ������dz��õĻ���ԭ�ϣ���Ҳ�Ǵ�������Ҫ��Ⱦ��ۺ���������Ⱦ�ǻ�����ѧ��ǰ����Ҫ�о�����֮һ��
��1��һ���¶��£���NH4HS������붨��������������ɲ��ַֽ�Ϊ����Ͱ�����NH4HS(s)![]() H2S(g)+NH3(g)
H2S(g)+NH3(g)
�ٿ����ж������ֽⷴӦ�Ѿ��ﵽ��ѧƽ�����_____________(ѡ����ĸ)
A�� ![]() B���ܱ���������ѹǿ����
B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ��� D���ܱ������а����������������
����������Ӧ��ƽ��ʱ��p(NH3)��p(H2S)=a(Pa2)����ƽ��ʱ�����е���ѹΪ_______________Pa(�ú�a�Ĵ���ʽ��ʾ)��(p(NH3)��p(H2S)�ֱ����NH3��H2S��ѹǿ��PaΪѹǿ�ĵ�λ)
��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
�¶�(��) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
ƽ��������Ũ��(��10��3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
��NH4HS�ֽⷴӦ���ʱ���H_________0(�>������=����<��)
��ͼ��������Ӧ������������Ũ����ʱ��仯��ʾ��ͼ����t2ʱ��������Ũ������t3ʱ��Ӧ�ٴδﵽƽ�⣬����ͼ�ϻ���t2ʱ�̺����⡢������Ũ����ʱ��ı仯����.(Ҫ�б�Ҫ��ע)____________

��2��һ���¶��£���Ӧ2SO2+O2![]() 2SO3���ﵽƽ��ʱ��n(SO2):n(O2):n(SO3)=2:3:4����С�������Ӧ�ٴδﵽƽ��ʱ��n(O2)=0.8mol��n(SO3)=1.4mol����ʱSO2�����ʵ���Ӧ��____________��
2SO3���ﵽƽ��ʱ��n(SO2):n(O2):n(SO3)=2:3:4����С�������Ӧ�ٴδﵽƽ��ʱ��n(O2)=0.8mol��n(SO3)=1.4mol����ʱSO2�����ʵ���Ӧ��____________��
��3��25��������ҺNa2SO3��Һ������SO2�Ĺ����У�pH��n(SO3- ):n(HSO3��)�仯��ϵ���±�:
n(SO32��):n(HSO3��) | 91��9 | 1��1 | 1��91 |
pH | ��.�� | 7.2 | 6.2 |
�ٵ�����Һ������ʱ����Һ������Ũ�ȹ�ϵ��ȷ����:______(ѡ����ĸ)
A��c(Na��)=2c(SO32- )��c(HSO3��)
B��c(Na��)> c(HSO3��)> c(SO32- )>c(H��)=c(OH��)
C��c(Na��)+c(H��)= c(SO32- )+ c(HSO3��)+c(OH��)
��������Һ��pH����ԼΪ6ʱ����������������������ʾ��ͼ��������д��HSO3- �������ŵ�ĵ缫��Ӧʽ��___________________��

��4����֪��CH��(g)+2O2(g) = CO2 (g) +��H2O (l) ��H= - Q1 kJ/mol
2H2��g��+O2��g�� = ��H2 O ��g�� �� H= - Q2 kJ/mol
2H2��g��+O2��g�� =��H2 O ��l�� �� H= - Q3 kJ/mol,
�����£�ȡ�����4:1�ļ���������Ļ������11.2L(���)������ȫȼ�ջָ����£��ų�����Ϊ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ǽ�������A��������ͼ��ʾ�Ĺ���ת��Ϊ������D����֪DΪ����ǿ����

��ش��������⣺
��1����A�ڳ�����Ϊ���壬B����ʹƷ����Һ��ɫ���д̼�����ζ����ɫ����
��B��D�Ļ�ѧʽ�ֱ���________��__________��
���ڹ�ҵ������B����Ĵ����ŷű���ˮ���պ��γ���________����Ⱦ�˻���
��д��ʵ������Cu��D��Ũ��Һ���Ʊ�B�Ļ�ѧ����ʽ��____________________________
��2����A�ڳ�����Ϊ���嵥����C�Ǻ���ɫ���壬��
��A��C�Ļ�ѧʽ�ֱ��ǣ�A_________��C________
����д��Cת����D�Ļ�ѧ����ʽ___________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���ܸ�AB���˷ֱ���������ͬ��������ȵĿ���ͭ��Ϳ��������ڸܸ˲�ʹ�䱣��ƽ�⣬Ȼ��С�ĵ���ˮ���е���ŨCuSO4��Һ��һ��ʱ��������йظܸ˵�ƫ���ж���ȷ����(ʵ������У�����������ĸ����仯)(����)

A. �ܸ�Ϊ������Ե��ʱ����ΪA�˸�B�˵�
B. �ܸ�Ϊ������Ե��ʱ����ΪA�˵�B�˸�
C. ���ܸ�Ϊ����ʱ��A�˵�B�˸�
D. ���ܸ�Ϊ����ʱ��A�˸�B�˵�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�������A����Է���������ΧΪ100��130����������֪������̼�������������֮��Ϊ46.66%������Ϊ������û������������ຬ̼��˫���ĸ���Ϊ�� ��
A.1
B.2
C.3
D.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�����ǿ��������Һ�д���������ǣ� ��
A.Na+��K+��SO42-��OH-B.Na+��K+��Cl-��HCO3-
C.Na+��Cu2����Cl-��SO42-D.NH4+��Ca2+��NO3-��CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�д��ڽ϶��H+��SO42-��NO3-������Һ�л����ܴ������ڵ���������
A.Mg2+��Ba2+��Br-B.Al3+��CH3COO-��Cl-
C.Mg2+��Cl-��Fe2+D.Na+��NH4+��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ء�����п����ػ�������;�dz��㷺���ش�����������
��1����̬пԭ�ӵļ۵����Ų�ʽΪ___________��K��F��Zn�ĵ縺�ԴӴ�С��˳��Ϊ___________��
��2��Zn��Caλ��ͬһ�������������������,�Ƶ��۵���е����п��,��ԭ����_______________��
��3��OF2���ӵļ��ι���Ϊ___________,����ԭ�ӵ��ӻ�����Ϊ___________��
��4��KOH ��O3��Ӧ�ɵõ�KO3(��������),KO3 �г�������,������___________;��O3-��Ϊ�ȵ�����ķ���Ϊ___________ (�� дһ�� )��
��5��K��F��Zn��ɵ�һ�־���ṹ��ͼ��ʾ,�侧������Ϊa=0.4058 nm��

��������Zn2+����λ��Ϊ___________����
�������н��ڵ�����F-��ľ���Ϊ_______________________(�г���ʽ����)nm��
���þ�����ܶ�Ϊ___________(�г���ʽ����,��NA��ʾ�����ӵ���������ֵ)g��cm-3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڻ�����β����ȾԽ��Խ���أ���֪��������[C3N3(OH)3]��������������β���е�NO2���������Ӧԭ��ΪC3N3(OH)3![]() 3HNCO��8HNCO+6NO2
3HNCO��8HNCO+6NO2![]() 7N2+8CO2+4H2O������˵����ȷ����
7N2+8CO2+4H2O������˵����ȷ����
A. C3N3(OH)3��HNCOΪͬһ����
B. 1 mol NO2�ڷ�Ӧ��ת�Ƶĵ���Ϊ4 mol
C. HNCO��һ�ֺ�ǿ��������
D. ��Ӧ��NO2�ǻ�ԭ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com