
【题目】非金属单质A,经如下图所示的过程转化为含氧酸D,已知D为常见强酸:

请回答下列问题:
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体
①B和D的化学式分别是________、__________。
②在工业生产中B气体的大量排放被雨水吸收后形成了________而污染了环境
③写出实验室用Cu和D的浓溶液来制备B的化学方程式:____________________________
(2)若A在常温下为气体单质,C是红棕色气体,则:
①A和C的化学式分别是:A_________,C________
②请写出C转化成D的化学方程式___________________
【答案】 SO2 H2SO4 酸雨 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O N2 NO2 3NO2+H2O=2HNO3+NO
CuSO4+SO2↑+2H2O N2 NO2 3NO2+H2O=2HNO3+NO
【解析】(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体,则A是S,B是SO2,C是SO3,D是H2SO4;①B和D的化学式分别是SO2、H2SO4;②在工业生产中SO2气体的大量排放被雨水吸收后形成了酸雨而污染了环境;③实验室用Cu和浓硫酸制备SO2的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;(2)若A在常温下为气体单质,C是红棕色气体,则A是氮气,B是NO,C是NO2,D是HNO3:①A和C的化学式分别是N2、NO2;②C转化成D的化学方程式为3NO2+H2O=2HNO3+NO。
CuSO4+SO2↑+2H2O;(2)若A在常温下为气体单质,C是红棕色气体,则A是氮气,B是NO,C是NO2,D是HNO3:①A和C的化学式分别是N2、NO2;②C转化成D的化学方程式为3NO2+H2O=2HNO3+NO。


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作、现象及得出的结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向盛有品红的两只试管中分别通入SO2和Cl2 | 品红均褪色 | 两者漂白原理相同 |
B | 向体积相同且pH均为3.3的一元酸HX和HY中分别加入足量锌粒 | 产生的H2前者比后者多 | HX、HY均是弱酸 |
C | 在难溶性FeS和CuS中分别加入0.3mol/L盐酸 | 前者溶解,后者不溶 | Ksp(FeS)>Ksp(CuS) |
D | 向盛有相同体积、10%H2O2溶液的两只试管中分别加入足量酸性KMnO4溶液和FeCl3溶液 | 前者产生的气体多 | KMnO4催化活性比FeCl3高 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g) ![]() 2C(g)+D(s),所得实验数据如下表:
2C(g)+D(s),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(A) | n(B) | n(C) | ||
① | 600 | 0.30 | 0.20 | 0.30 |
② | 700 | 0.20 | 0.30 | 0.24 |
③ | 800 | 0.10 | 0.10 | a |
下列说法不正确的是
A. 实验①中,若5min时测得n(B)=0.050mol,则0至5min时间内平均反应速率v(A)=0.015mol/(L·min)
B. 实验②中达到平衡后,增大压强,A的转化率不变,平衡常数不变
C. 700℃时该反应的平衡常数K=4.0
D. 实验③中,达到平衡时,a>0.10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铋酸钠(NaBiNO3)检验溶液中的Mn2+,反应方程式为:4MnSO4+10NaBiO3+14H2SO4═4NaMnO4+5Bi2(SO4)3+3Na2SO4+口,下列说法不正确的是
A. 口内的物质为水,配平系数为14。
B. 若生成1mol NaMnO4,则转移5mole-
C. 反应方程式中的硫酸可换为盐酸
D. 溶液中有Mn2+的现象是溶液变为紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以由下列反应合成三聚氰胺:CaO+3C ![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2 ![]() CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2 , NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.
CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2 , NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.
(1)写出与Ca在同一周期且最外层电子数为1、内层电子全排满的基态原子的核外电子排布式: .
(2)CaCN2中阴离子为CN ![]() ,与CN
,与CN ![]() 互为等电子体的分子有N2O和(填化学式),由此可以推知CN
互为等电子体的分子有N2O和(填化学式),由此可以推知CN ![]() 的空间构型为 .
的空间构型为 .
(3)尿素分子中C原子采取杂化.尿素分子的结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气.为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,反应装置略去).
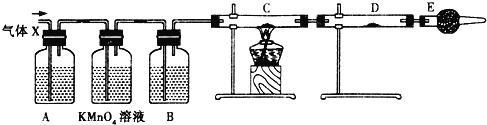
注:C中为氧化铜粉末,试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为:________________________________;
(2)乙同学认为还可能产生氢气的理由是:____________________________________;
(3)丙同学在安装好装置后,必不可少的一步操作是:__________________________;
(4)A中试剂是______,D中试剂是______;
(5)E装置的作用是_________________________;
(6)可以证明气体X中含有氢气的实验现象是:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O,Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
2Pb(BF4)2+2H2O,Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A. 放电时,负极反应为:PbO2+4HBF4-2e-=Pb(BF4)2+2BF4-+2H2O
B. 充电时,当正极质量减少23.9g时转移0.2mol电子
C. 放电时,PbO2电极附近溶液的pH增大
D. 充电时,Pb电极的电极反应式为PbO2+4H++2e-=Pb2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如图所示. 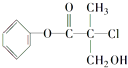
由A的结构推测,它能(填字母).
a.使溴的四氯化碳溶液褪色
b.使酸性KMnO4溶液褪色
c.和稀硫酸混合加热,可以发生取代反应
d.与Na2CO3溶液作用生成CO2
e.1mol A和足量的NaOH溶液反应,最多可以消耗3mol NaOH
f.和NaOH醇溶液混合加热,可以发生消去反应
g.1mol A和足量的H2反应,最多可以消耗4mol H2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强氧化剂XO(OH)2+被Na2SO3还原。如果还原2.4×10-3molXO(OH) 2+,需用30mL0.2mol·L-1的Na2SO3溶液,那么X元素被还原后的价态是( )
A.-1B.0C.+1D.+2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com