
【题目】某强氧化剂XO(OH)2+被Na2SO3还原。如果还原2.4×10-3molXO(OH) 2+,需用30mL0.2mol·L-1的Na2SO3溶液,那么X元素被还原后的价态是( )
A.-1B.0C.+1D.+2
科目:高中化学 来源: 题型:
【题目】非金属单质A,经如下图所示的过程转化为含氧酸D,已知D为常见强酸:

请回答下列问题:
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体
①B和D的化学式分别是________、__________。
②在工业生产中B气体的大量排放被雨水吸收后形成了________而污染了环境
③写出实验室用Cu和D的浓溶液来制备B的化学方程式:____________________________
(2)若A在常温下为气体单质,C是红棕色气体,则:
①A和C的化学式分别是:A_________,C________
②请写出C转化成D的化学方程式___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是
A.Mg2+、Ba2+、Br-B.Al3+、CH3COO-、Cl-
C.Mg2+、Cl-、Fe2+D.Na+、NH4+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾、氟及锌的相关化合物用途非常广泛。回答下列问题:
(1)基态锌原子的价电子排布式为___________;K、F、Zn的电负性从大到小的顺序为___________。
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是_______________。
(3)OF2分子的几何构型为___________,中心原子的杂化类型为___________。
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在___________;与O3-互为等电子体的分子为___________ (任 写一种 )。
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。

①晶胞中Zn2+的配位数为___________个。
②晶胞中紧邻的两个F-间的距离为_______________________(列出算式即可)nm。
③该晶体的密度为___________(列出算式即可,用NA表示阿伏加德罗常数的数值)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米碳酸钙是一种广泛应用于塑料、食品、医药、饲料等行业的重要无机填料。以磷石膏钙渣为原料制取高品质纳米碳酸钙的工艺流程如下:
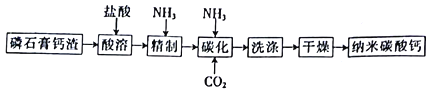
已知某磷石膏钙渣的主要成分及其含量如下表所示。
CaO | P2O5 | SO3 | Fe2O3 | Al2O3 | SiO2 | 烧失量 |
47.70% | 1.60% | 1.77% | 0.041% | 0.0027% | 9.85% | 37.69% |
请回答下列问题:
(1)对磷石膏钙渣进行酸溶的目的是获得机制CaCl2溶液,为了提高溶出率,可以采取的措施有___________(填字母)。
A.粉碎磷石膏钙渣 B.增大盐酸浓度 C.适当降低温度 D.缩短酸溶时间
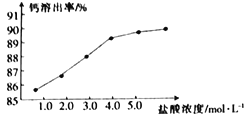
(2)为了探究酸溶的工艺条件,称取6 份各50g磷石膏钙渣,分别用不同浓度盐酸进行溶解,反应时间为30 min,测得滤液中钙溶出率的结果如图所示,最适宜的盐酸浓度为___________。
(3)精制是向粗制CaCl2溶液中通入氨气,控制溶液的pH,主要除去___________(填金属阳离子)。
(4)碳化时,先将精制CaCl2溶液稀释至一定体积,控制反应温度以及NH3和CO2 的通入量,此过程中,通入气体有先后顺序,应先通入气体的化学式___________(填化学式);碳化时发生反应的化学方程式为___________________________________________。
(5)把CaCO3浊液滴入1.0mol·L-1 的Na2SO3溶液中,能否产生CaSO3沉淀?___________。若不能,说明原因;若能,请从定量的角度简述判断依据:___________________________________。[已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9
(6)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠广泛应用于染料工业。请完成下列各题:
(1)![]() 的核外电子排布式_______________,其核外有_______种不同运动状态的电子。写出Na2O的电子式___________,比较Na2O和Na2S的熔点高低:Na2O______Na2S。
的核外电子排布式_______________,其核外有_______种不同运动状态的电子。写出Na2O的电子式___________,比较Na2O和Na2S的熔点高低:Na2O______Na2S。
(2)O、S属于同主族元素,其单质的氧化性不同,用一反应的化学方程式表示:_____________,O、S、![]() 半径从大到小的顺序是_________________。
半径从大到小的顺序是_________________。
II.1100℃时,在体积固定且为5L的密闭容器中,发生可逆反应: ![]() 并达到平衡。
并达到平衡。
(1)上述平衡的平衡常数表达式![]() _____________。欲使
_____________。欲使![]() 值变大,可采取的措施是__________________________。平衡后,向容器中充入1mol H2,平衡向__________(填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,逆反应速率______(填“增大”、“减小”或“不变”)。
值变大,可采取的措施是__________________________。平衡后,向容器中充入1mol H2,平衡向__________(填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,逆反应速率______(填“增大”、“减小”或“不变”)。
(2)若混合气体的密度不变,(填“能”或“不能”)_________判断该反应已经达到平衡状态。若初始时加入的Na2SO4为2.84g,10分钟后达到平衡时Na2SO4的转化率为45%, ![]() ________。
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄曲霉素AFTB1(如图)是污染粮食的真菌霉素.人类的特殊基因在黄曲霉素的作用下会发生突变,有转变成肝癌的可能性.与1mol黄曲霉素起反应的H2或NaOH的最大量分别是( ) 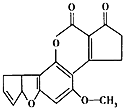
A.6mol,2mol
B.7mol,2mol
C.6mol,1mol
D.7mol,1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】城市内机动车尾气污染越来越严重,已知三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其基本反应原理为C3N3(OH)3![]() 3HNCO,8HNCO+6NO2
3HNCO,8HNCO+6NO2![]() 7N2+8CO2+4H2O。下列说法正确的是
7N2+8CO2+4H2O。下列说法正确的是
A. C3N3(OH)3与HNCO为同一物质
B. 1 mol NO2在反应中转移的电子为4 mol
C. HNCO是一种很强的氧化剂
D. 反应中NO2是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO(g)+Br2(g)![]() 2NOBr(g)(正反应放热)。下列说法正确的是
2NOBr(g)(正反应放热)。下列说法正确的是
容器 编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(NO) | c(Br2) | c(NOBr) | c(NOBr) | |
I | 0.3 | 0.15 | 0.1 | 0.2 |
II | 0.4 | 0.2 | 0 | |
III | 0 | 0 | 0.2 | |
A. 容器II达平衡所需的时间为4min,则v(Br2)=0.05mol/(Lmin)
B. 达平衡时,容器I与容器III中的总压强之比为2:1
C. 升高温度,逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
D. 达平衡时,容器II中c(Br2)/c(NOBr)比容器III中的小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com