
【题目】某温度下,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO(g)+Br2(g)![]() 2NOBr(g)(正反应放热)。下列说法正确的是
2NOBr(g)(正反应放热)。下列说法正确的是
容器 编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(NO) | c(Br2) | c(NOBr) | c(NOBr) | |
I | 0.3 | 0.15 | 0.1 | 0.2 |
II | 0.4 | 0.2 | 0 | |
III | 0 | 0 | 0.2 | |
A. 容器II达平衡所需的时间为4min,则v(Br2)=0.05mol/(Lmin)
B. 达平衡时,容器I与容器III中的总压强之比为2:1
C. 升高温度,逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
D. 达平衡时,容器II中c(Br2)/c(NOBr)比容器III中的小
【答案】D
【解析】A、 容器I中 2NO(g)+Br2(g)![]() 2NOBr(g),
2NOBr(g),
c始/mol·L-1 0.3 0.15 0.1
c变/mol·L-1 0.1 0.05 0.1
c平/mol·L-1 0.2 0.10 0.2
K=![]() =10
=10
容器Ⅱ中 2NO(g)+Br2(g)![]() 2NOBr(g),
2NOBr(g),
c始/mol·L-1 0.4 0.2 0
c变/mol·L-1 2x x 2x
c平/mol·L-1 0.4- 2x 0.2-x 2x
K=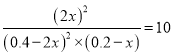 ,解得x=0.1mol·L-1,v(Br2)=0.1mol·L-1/4min== 0.025mol/(Lmin),故A错误;B、将容器I、容器III的生成物全部转化成反应物,容器I的投料相当于容器III的2倍,达平衡时,容器I相当于对2个容器III进行加压,平衡正向移动,容器I与容器III中的总压强之比小于2:1,故B错误;C、升高温度,逆反应速率增大,正反应速率也增大,故C错误;D、将容器II、容器III的生成物全部转化成反应物,容器II的投料相当于容器III的2倍,达平衡时,容器II相当于对2个容器III进行加压,平衡正向移动,容器II中c(Br2)减小,c(NOBr)增大,容器II中c(Br2)/c(NOBr)比容器III中的小,故D正确;故选D。
,解得x=0.1mol·L-1,v(Br2)=0.1mol·L-1/4min== 0.025mol/(Lmin),故A错误;B、将容器I、容器III的生成物全部转化成反应物,容器I的投料相当于容器III的2倍,达平衡时,容器I相当于对2个容器III进行加压,平衡正向移动,容器I与容器III中的总压强之比小于2:1,故B错误;C、升高温度,逆反应速率增大,正反应速率也增大,故C错误;D、将容器II、容器III的生成物全部转化成反应物,容器II的投料相当于容器III的2倍,达平衡时,容器II相当于对2个容器III进行加压,平衡正向移动,容器II中c(Br2)减小,c(NOBr)增大,容器II中c(Br2)/c(NOBr)比容器III中的小,故D正确;故选D。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】某强氧化剂XO(OH)2+被Na2SO3还原。如果还原2.4×10-3molXO(OH) 2+,需用30mL0.2mol·L-1的Na2SO3溶液,那么X元素被还原后的价态是( )
A.-1B.0C.+1D.+2
查看答案和解析>>
科目:高中化学 来源: 题型:
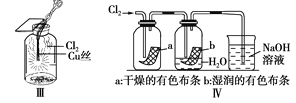
【题目】某同学用下列装置制备并检验Cl2的性质,下列说法正确的是( )

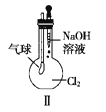
A. Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
B. Ⅱ图中:若气球干瘪,证明Cl2可与NaOH反应
C. Ⅲ图中:生成蓝色的烟
D. Ⅳ图中:湿润的有色布条褪色;将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某纯碱样品中含有杂质氯化钠,为测定样品中纯碱的质量分数,可用如图装置进行实验。
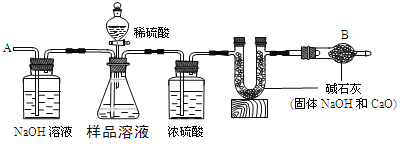
主要步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g样品放入锥形瓶中,加适量蒸馏水溶解,得到样品溶液
③称量盛有碱石灰的U型管的质量为b g
④由分液漏斗滴入5%的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量空气
⑥再次称量盛有碱石灰的U型管的质量为c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,称量其质量为d g
请回答下列问题:
(1)步骤③称量用的主要仪器是_________________________
(2)锥形瓶中发生反应的离子方程式为_____________________________
(3)装置中干燥管B的作用是_____________________________
(4)如果将分液漏斗中的硫酸换成相同浓度的盐酸,测试的结果_______(填偏高、偏低或不变)
(5)步骤⑤的目的是_______________________
(6)步骤⑦的目的是_______________________
(7)该样品中纯碱的质量分数的计算式为_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见物质A~K之间存在如下图所示的转化关系,其中D、E为单质,请回答下列问题(图中有些反应的产物和反应的条件没有全部标出)。
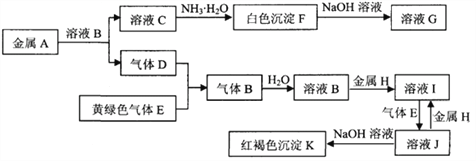
(1)写出下列物质中溶质的名称:B是 __________,G是____________
(2)反应“F→G”的化学方程式是_____________________________________________
(3)反应“J→I”的离子方程式是_____________________________________________
(4)溶液I中混有溶液J,除去J的方法是:___________________________
(5)检验溶液I中阳离子的方法是:__________________________
(6)向30 mL 1 mol·L-1的C溶液中逐渐加入浓度为4 mol·L-1的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为______________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是气体性质实验的常用装置,下列对有关实验现象的说法中不正确的是( )
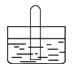
A.若水槽中是NaOH溶液,试管中是Cl2,可看到液面上升,试管中黄绿色褪去
B.若水槽中是水(并滴有酚酞),试管中是NH3,可看到液面上升并呈红色
C.若水槽中是水,试管中是NO2,可看到试管中液面上升并充满整个试管
D.若水槽中和试管中都是氯水,光照后可在试管中收集到氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是
A. K+、MnO4-、Cl-、SO42-
B. Na+、CO32-、SO42-、Cl-
C. NO3-、Na+、HCO3-、Mg2+
D. Na+、NO3-、H+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是
A.干冰、氢气、冰水混合物B.洁净的空气、液态氧、天然气
C.纯碱、氦气、盐酸D.酒精、氨水、氢氧化铁胶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com