
【题目】已知甲醛( ![]() )分子中的四个原子是共平面的,下列分子中所有原子不可能同时存在同一平面上的是( )
)分子中的四个原子是共平面的,下列分子中所有原子不可能同时存在同一平面上的是( )
A.
B.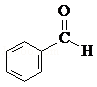
C.
D.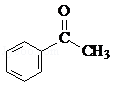
科目:高中化学 来源: 题型:
【题目】钾、氟及锌的相关化合物用途非常广泛。回答下列问题:
(1)基态锌原子的价电子排布式为___________;K、F、Zn的电负性从大到小的顺序为___________。
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是_______________。
(3)OF2分子的几何构型为___________,中心原子的杂化类型为___________。
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在___________;与O3-互为等电子体的分子为___________ (任 写一种 )。
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。

①晶胞中Zn2+的配位数为___________个。
②晶胞中紧邻的两个F-间的距离为_______________________(列出算式即可)nm。
③该晶体的密度为___________(列出算式即可,用NA表示阿伏加德罗常数的数值)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】城市内机动车尾气污染越来越严重,已知三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其基本反应原理为C3N3(OH)3![]() 3HNCO,8HNCO+6NO2
3HNCO,8HNCO+6NO2![]() 7N2+8CO2+4H2O。下列说法正确的是
7N2+8CO2+4H2O。下列说法正确的是
A. C3N3(OH)3与HNCO为同一物质
B. 1 mol NO2在反应中转移的电子为4 mol
C. HNCO是一种很强的氧化剂
D. 反应中NO2是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中,若忽略水的电离,只含有下表中所示的四种离子,推测X离子及其个数b可能为
离子 | Na+ | Al3+ | Cl- | X |
个数 | 3a | 2a | a | b |
A.OH-、8aB.NO3-、4aC.SO42-、4aD.SO42-、8a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A. 2.0gH218O与2.0gD2O中所含的中子数均为NA
B. 14g分子式为CnH2n的烃中含有的碳碳双键数为NA/n
C. 100g质量分数为17%的H2O2水溶液中氢原子数为NA
D. 常温下,将56g铁片投入到足量的浓硫酸中生成SO2的分子数为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用化学方程式解释现行高中化学教材中的下列事实:
(1)用FeCl3溶液制作印刷电路板:_________________________________
(2)工业制漂白粉:______________________________________________
(3)由石英砂制粗硅:_____________________________________________
(4)玻璃刻花的反应原理:_____________________________________________
(5)盛放NaOH溶液的试剂瓶不能用玻璃塞:_______________________________
(6)氢氧化钠溶液腐蚀金属铝:_____________________________________________
(7)单质硅与氢氧化钠溶液的反应:__________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO(g)+Br2(g)![]() 2NOBr(g)(正反应放热)。下列说法正确的是
2NOBr(g)(正反应放热)。下列说法正确的是
容器 编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(NO) | c(Br2) | c(NOBr) | c(NOBr) | |
I | 0.3 | 0.15 | 0.1 | 0.2 |
II | 0.4 | 0.2 | 0 | |
III | 0 | 0 | 0.2 | |
A. 容器II达平衡所需的时间为4min,则v(Br2)=0.05mol/(Lmin)
B. 达平衡时,容器I与容器III中的总压强之比为2:1
C. 升高温度,逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
D. 达平衡时,容器II中c(Br2)/c(NOBr)比容器III中的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下述正确的是
A. 64g二氧化硫SO2含有原子数为3NA
B. 1L 1mol/L的氯化钠溶液中,所含离子数为NA
C. 标准状况下,11.2L水所含分子数为0.5 NA
D. 在反应中,1mol镁转化为Mg2+后失去的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系。

(1)如果A、B、C、D均是10电子微粒,请写出A的化学式:___________;D的化学式__________。
(2)如果A和C是18电子的微粒,B和D是10电子的微粒,请写出A与B在溶液中反应的离子方程式:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com