
【题目】某同学用下列装置制备并检验Cl2的性质,下列说法正确的是( )

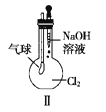
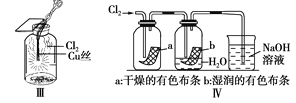
A. Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
B. Ⅱ图中:若气球干瘪,证明Cl2可与NaOH反应
C. Ⅲ图中:生成蓝色的烟
D. Ⅳ图中:湿润的有色布条褪色;将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案科目:高中化学 来源: 题型:
【题目】某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是
A.Mg2+、Ba2+、Br-B.Al3+、CH3COO-、Cl-
C.Mg2+、Cl-、Fe2+D.Na+、NH4+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄曲霉素AFTB1(如图)是污染粮食的真菌霉素.人类的特殊基因在黄曲霉素的作用下会发生突变,有转变成肝癌的可能性.与1mol黄曲霉素起反应的H2或NaOH的最大量分别是( ) 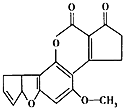
A.6mol,2mol
B.7mol,2mol
C.6mol,1mol
D.7mol,1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】城市内机动车尾气污染越来越严重,已知三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其基本反应原理为C3N3(OH)3![]() 3HNCO,8HNCO+6NO2
3HNCO,8HNCO+6NO2![]() 7N2+8CO2+4H2O。下列说法正确的是
7N2+8CO2+4H2O。下列说法正确的是
A. C3N3(OH)3与HNCO为同一物质
B. 1 mol NO2在反应中转移的电子为4 mol
C. HNCO是一种很强的氧化剂
D. 反应中NO2是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氧化还原反应,下列说法正确的是( )
A.失去电子,化合价降低的物质是还原剂B.被氧化的物质是还原剂
C.氧化剂被氧化,还原剂被还原D.氧化剂失去电子,化合价升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中,若忽略水的电离,只含有下表中所示的四种离子,推测X离子及其个数b可能为
离子 | Na+ | Al3+ | Cl- | X |
个数 | 3a | 2a | a | b |
A.OH-、8aB.NO3-、4aC.SO42-、4aD.SO42-、8a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A. 2.0gH218O与2.0gD2O中所含的中子数均为NA
B. 14g分子式为CnH2n的烃中含有的碳碳双键数为NA/n
C. 100g质量分数为17%的H2O2水溶液中氢原子数为NA
D. 常温下,将56g铁片投入到足量的浓硫酸中生成SO2的分子数为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO(g)+Br2(g)![]() 2NOBr(g)(正反应放热)。下列说法正确的是
2NOBr(g)(正反应放热)。下列说法正确的是
容器 编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(NO) | c(Br2) | c(NOBr) | c(NOBr) | |
I | 0.3 | 0.15 | 0.1 | 0.2 |
II | 0.4 | 0.2 | 0 | |
III | 0 | 0 | 0.2 | |
A. 容器II达平衡所需的时间为4min,则v(Br2)=0.05mol/(Lmin)
B. 达平衡时,容器I与容器III中的总压强之比为2:1
C. 升高温度,逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
D. 达平衡时,容器II中c(Br2)/c(NOBr)比容器III中的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中的珊瑚虫经如下反应形成石灰石外壳,进而形成珊瑚:![]() 。与珊瑚虫共生的藻类会消耗海洋中的
。与珊瑚虫共生的藻类会消耗海洋中的![]() 。气候变暖、温室效应的加剧干扰了珊瑚虫的生长,甚至致其死亡。下列说法不合理的是
。气候变暖、温室效应的加剧干扰了珊瑚虫的生长,甚至致其死亡。下列说法不合理的是
A. 共生藻类消耗![]() ,有利于珊瑚的形成
,有利于珊瑚的形成
B. 海洋中![]() 浓度升高,抑制了珊瑚的形成
浓度升高,抑制了珊瑚的形成
C. 温度升高会增大![]() 在海水中的溶解度,抑制了珊瑚的形成
在海水中的溶解度,抑制了珊瑚的形成
D. 将![]() 转化为甲醇等化工原料,有助于缓解温室效应
转化为甲醇等化工原料,有助于缓解温室效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com