
����Ŀ����ͼ����������ʵ��ij���װ�ã����ж��й�ʵ�������˵���в���ȷ����( )
A����ˮ������NaOH��Һ���Թ�����Cl2���ɿ���Һ���������Թ��л���ɫ��ȥ
B����ˮ������ˮ(�����з�̪)���Թ�����NH3���ɿ���Һ���������ʺ�ɫ
C����ˮ������ˮ���Թ�����NO2���ɿ����Թ���Һ�����������������Թ�
D����ˮ���к��Թ��ж�����ˮ�����պ�����Թ����ռ�������
���𰸡�C
��������
���������A����ˮ������NaOH��Һ���Թ�����Cl2��������Cl2+2NaOH=NaCl+NaClO+H2O�����������գ��ɿ���Һ���������Թ��л���ɫ��ȥ����A��ȷ��B��NH3��������ˮ������Һ�з�����NH3H20![]() NH4++OH-����Һ�ʼ��ԣ��ɿ���Һ���������ʺ�ɫ����B��ȷ��C��NO2��ˮ��Ӧ���������NO��NO������ˮ��ˮ���ܳ��������Թܣ���C����D����ˮ�к���HClO�����������·ֽ�������������D��ȷ����ѡC��
NH4++OH-����Һ�ʼ��ԣ��ɿ���Һ���������ʺ�ɫ����B��ȷ��C��NO2��ˮ��Ӧ���������NO��NO������ˮ��ˮ���ܳ��������Թܣ���C����D����ˮ�к���HClO�����������·ֽ�������������D��ȷ����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ù��AFTB1����ͼ������Ⱦ��ʳ�����ù�أ��������������ڻ���ù�ص������»ᷢ��ͻ�䣬��ת��ɸΰ��Ŀ����ԣ���1mol����ù����Ӧ��H2��NaOH��������ֱ��ǣ� �� 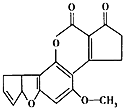
A.6mol��2mol
B.7mol��2mol
C.6mol��1mol
D.7mol��1mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�������й�������ȷ����
A. 2.0gH218O��2.0gD2O����������������ΪNA
B. 14g����ʽΪCnH2n�����к��е�̼̼˫����ΪNA/n
C. 100g��������Ϊ17%��H2O2ˮ��Һ����ԭ����ΪNA
D. �����£���56g��ƬͶ�뵽������Ũ����������SO2�ķ�����Ϊ1.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£��������ݻ���Ϊ1L�ĺ����ܱ������н�������Ӧ: 2NO(g)+Br2(g)![]() 2NOBr(g)������Ӧ������������˵����ȷ����
2NOBr(g)������Ӧ������������˵����ȷ����
���� ��� | ���ʵ���ʼŨ��(mol/L) | ���ʵ�ƽ��Ũ��(mol/L) | ||
c(NO) | c(Br2) | c(NOBr) | c(NOBr) | |
I | 0.3 | 0.15 | 0.1 | 0.2 |
II | 0.4 | 0.2 | 0 | |
III | 0 | 0 | 0.2 | |
A. ����II��ƽ�������ʱ��Ϊ4min����v(Br2)=0.05mol/(Lmin)
B. ��ƽ��ʱ������I������III�е���ѹǿ֮��Ϊ2:1
C. �����¶ȣ��淴Ӧ������������Ӧ���ʼ�С��ƽ�����淴Ӧ�����ƶ�
D. ��ƽ��ʱ������II��c(Br2)/c(NOBr)������III�е�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C1O2��һ�����͵Ļ�������ˮ��������ij����С����ѡ�����в���װ���Ʊ����ռ�����������̽����Ư���ԣ�װ�ò����ظ�ʹ������
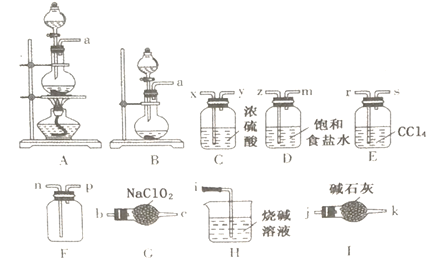
��֪�������£�����������NaC1O2)�������������Ʊ��������ȣ�C1O2��һ��������ˮ���������л��ܼ������壬�����Ա�����ǿ��
�ش��������⣺
��1���Ʊ�����������������Ʊ��ķ���װ����_________ (�����)��//д����Ӧ�����ӷ���ʽ��__________��
��2���Ʊ��������ȣ����ܿ�����˳��Ϊ��a��______��n��p��j����ʵ��ѡ��I����ѡ��H��ԭ���ǣ�_________________��
��3��д��G�з�����Ӧ�Ļ�ѧ����ʽ��___________��
��4��װ��E��������_____________________________��
��5�����Ǽ��ռ�һƿ�����������壬������Ƽ���ʵ��֤���������Ⱦ������õ�Ư���ԣ�_________________________________________________________________________________________��
��6��β���еĶ������Ȼ������ú�˫��ˮ���ռ���Һ���գ������֮һ��NaC1O2��д���÷�Ӧ�Ļ�ѧ����ʽ��_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������������ȷ����
A. 64g��������SO2����ԭ����Ϊ3NA
B. 1L 1mol/L���Ȼ�����Һ�У�����������ΪNA
C. ��״���£�11.2Lˮ����������Ϊ0.5 NA
D. �ڷ�Ӧ�У�1molþת��ΪMg2+��ʧȥ�ĵ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ��������İ����漰����װ�ã�������ȷ����
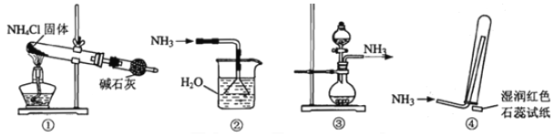
A. ���ǰ�������װ�� B. ���ǰ�������װ��
C. ���ǰ�������װ�� D. ���ǰ����ռ�������װ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������е�ɺ���澭���·�Ӧ�γ�ʯ��ʯ��ǣ������γ�ɺ����![]() ����ɺ���湲������������ĺ����е�
����ɺ���湲������������ĺ����е�![]() �������ů������ЧӦ�ļӾ������ɺ�����������������������������˵������������
�������ů������ЧӦ�ļӾ������ɺ�����������������������������˵������������
A. ������������![]() ��������ɺ�����γ�
��������ɺ�����γ�
B. ������![]() Ũ�����ߣ�������ɺ�����γ�
Ũ�����ߣ�������ɺ�����γ�
C. �¶���������![]() �ں�ˮ�е��ܽ�ȣ�������ɺ�����γ�
�ں�ˮ�е��ܽ�ȣ�������ɺ�����γ�
D. ��![]() ת��Ϊ�״��Ȼ���ԭ�ϣ������ڻ�������ЧӦ
ת��Ϊ�״��Ȼ���ԭ�ϣ������ڻ�������ЧӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѪҺ�������Ҫ�����ƽ�⣺![]() ��ʹ����ѪҺpH������7.35��7.45������ͻᷢ�����ж�����ж�����pH��
��ʹ����ѪҺpH������7.35��7.45������ͻᷢ�����ж�����ж�����pH��![]() �仯��ϵ���±���
�仯��ϵ���±���
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
����˵������ȷ����
A. ��������ѪҺ�У� ![]() ��ˮ��̶ȴ��ڵ���̶�
��ˮ��̶ȴ��ڵ���̶�
B. ����ѪҺ���ж�ʱ����ע��![]() ��Һ����
��Һ����
C. ![]() ��ѪҺ�У�
��ѪҺ�У� ![]()
D. pH=7.40��ѪҺ�У� ![]() ��ˮ��̶�һ������
��ˮ��̶�һ������![]() �ĵ���̶�
�ĵ���̶�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com