
【题目】人体血液里存在重要的酸碱平衡:![]() ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随![]() 变化关系如下表:
变化关系如下表:
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是
A. 正常人体血液中, ![]() 的水解程度大于电离程度
的水解程度大于电离程度
B. 人体血液酸中毒时,可注射![]() 溶液缓解
溶液缓解
C. ![]() 的血液中,
的血液中, ![]()
D. pH=7.40的血液中, ![]() 的水解程度一定大于
的水解程度一定大于![]() 的电离程度
的电离程度
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】如图是气体性质实验的常用装置,下列对有关实验现象的说法中不正确的是( )
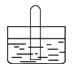
A.若水槽中是NaOH溶液,试管中是Cl2,可看到液面上升,试管中黄绿色褪去
B.若水槽中是水(并滴有酚酞),试管中是NH3,可看到液面上升并呈红色
C.若水槽中是水,试管中是NO2,可看到试管中液面上升并充满整个试管
D.若水槽中和试管中都是氯水,光照后可在试管中收集到氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空.
(1)下列两幅谱图是结构简式为CH3CH2CH2OH和CH3CH(OH)CH3的两种有机化合物的1H核磁共振谱图.请判断哪一幅是CH3CH(OH)CH3的1H﹣NMR谱图。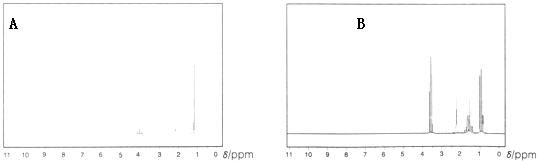
答:
(2)写出下列有机物的结构简式
异戊烷 氯乙烷
丙烯 乙酸乙酯
(3)下图是维生素A的分子结构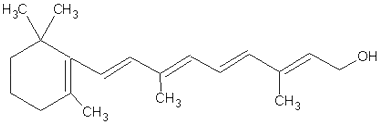
维生素A中的含氧官能团是(写名称),维生素A的分子式是
(4)写出C3H5Cl的链状的所有同分异构体 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是
A.干冰、氢气、冰水混合物B.洁净的空气、液态氧、天然气
C.纯碱、氦气、盐酸D.酒精、氨水、氢氧化铁胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( ) 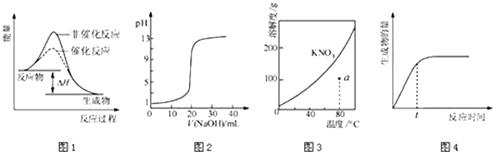
A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示0.1000molL﹣1NaOH溶液滴定20.00mL0.1000molL﹣1CH3COOH溶液所得到的滴定曲线
C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
D.图4 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是制作电子集成电路的基础材料.科学家预测,到2011年一个电脑芯片上将会集成10亿个晶体管,其功能远比我们想象的要大得多,这对硅的纯度要求很高。用化学方法可制得高纯硅,有关化学反应方程式为:①SiO2+2C![]() Si+2CO↑ ②Si+2Cl2
Si+2CO↑ ②Si+2Cl2![]() SiCl4 ③SiCl4+2H2
SiCl4 ③SiCl4+2H2![]() Si+4HCl
Si+4HCl
下列有关说法不正确的是
A. ②是化合反应 B. ①②③是氧化还原反应
C. ①③是置换反应 D. ①③是复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重114 g,则某气体的相对分子质量为( )
A. 32 B. 60 C. 28 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】功能高分子P可用作光电材料,其合成路线如下:

已知:
i: ![]() (R,R’表示氢或烃基)
(R,R’表示氢或烃基)
ii. 
iii. 
(1)烃A的相对分子质量是26,其结构简式是_________。
(2)反应①的反应类型是__________。
(3)C中含有的官能团名称是___________。
(4)D为苯的同系物,反应③的化学方程式是_________。
(5)G的结构简式是__________。
(6)反应⑨的化学方程式是__________。
(7)反应⑤和⑦的目的是___________。
(8)以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:
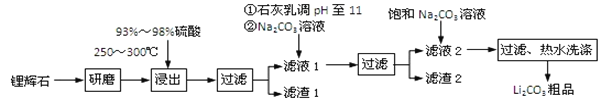
已知:
①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2 + H2SO4(浓) ![]() Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
③某些物质的溶解度(s)如下表所示。
T/℃ | 20 | 40 | 60 | 80 |
s(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
s(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣Ⅰ中分离出Al2O3的流程如下图所示。请写出生成沉淀的离子方程式______。
![]()
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)________________________________________________。
(3)最后一个步骤中,用“热水洗涤”的原因是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________
②电解后,LiOH溶液浓度增大的原因_________________,b中生成Li2CO3反应的化学方程式是___________________________________________。
(5)磷酸亚铁锂电池总反应为:FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com