
����Ŀ����Ҫ�����.
��1������������ͼ�ǽṹ��ʽΪCH3CH2CH2OH��CH3CH��OH��CH3�������л��������1H�˴Ź�����ͼ�����ж���һ����CH3CH��OH��CH3��1H��NMR��ͼ��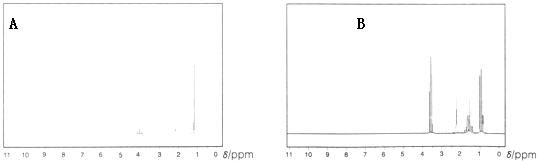
��
��2��д�������л���Ľṹ��ʽ
������ ������
��ϩ ��������
��3����ͼ��ά����A�ķ��ӽṹ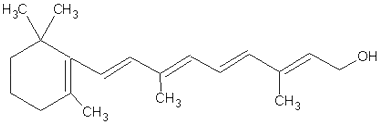
ά����A�еĺ�������������д���ƣ���ά����A�ķ���ʽ��
��4��д��C3H5Cl����״������ͬ���칹�� ��
���𰸡�
��1��A
��2��CH3CH��CH3��CH2CH3��CH3CH2Cl��CH3��CH=CH2��CH3COOCH2CH3
��3���ǻ���C20H30O
��4��![]()
���������⣺��1.���ӽṹ�Ϸ�����CH3CH��OH��CH3�����ֲ�ͬ��ѧ������H��������CH3CH2CH2OH�����ֲ�ͬ��H���ʴ�ͼ�Ϸ�����A���������壬��B���ĸ��壬��A��CH3CH��OH��CH3��1H��NMR��ͼ����ѡ��A��
��2.��������Ľṹ��ʽΪ��CH3CH��CH3��CH2CH3��������Ľṹ��ʽΪ��CH3CH2Cl����ϩ�Ľṹ��ʽΪ��CH3��CH=CH2�����������Ľṹ��ʽΪ��CH3COOCH2CH3�����Դ��ǣ�CH3CH��CH3��CH2CH3��CH3CH2Cl��CH3��CH=CH2��CH3COOCH2CH3��
��3.������ά����A�Ľṹ��ʽ���Կ������еĹ�����Ϊ�ǻ�������ʽΪC20H30O�����Դ��ǣ��ǻ���C20H30O��
��4.��C3H5C1����һ��˫�����ʿ�ȷ����̼�Ǽ�ΪC��C=C��������һ�ȴ�����3�֣� ![]() ��
��
���Դ��ǣ� ![]() ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�������й�������ȷ����
A. 2.0gH218O��2.0gD2O����������������ΪNA
B. 14g����ʽΪCnH2n�����к��е�̼̼˫����ΪNA/n
C. 100g��������Ϊ17%��H2O2ˮ��Һ����ԭ����ΪNA
D. �����£���56g��ƬͶ�뵽������Ũ����������SO2�ķ�����Ϊ1.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ��������İ����漰����װ�ã�������ȷ����
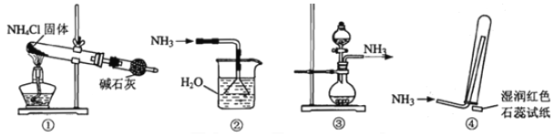
A. ���ǰ�������װ�� B. ���ǰ�������װ��
C. ���ǰ�������װ�� D. ���ǰ����ռ�������װ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������е�ɺ���澭���·�Ӧ�γ�ʯ��ʯ��ǣ������γ�ɺ����![]() ����ɺ���湲������������ĺ����е�
����ɺ���湲������������ĺ����е�![]() �������ů������ЧӦ�ļӾ������ɺ�����������������������������˵������������
�������ů������ЧӦ�ļӾ������ɺ�����������������������������˵������������
A. ������������![]() ��������ɺ�����γ�
��������ɺ�����γ�
B. ������![]() Ũ�����ߣ�������ɺ�����γ�
Ũ�����ߣ�������ɺ�����γ�
C. �¶���������![]() �ں�ˮ�е��ܽ�ȣ�������ɺ�����γ�
�ں�ˮ�е��ܽ�ȣ�������ɺ�����γ�
D. ��![]() ת��Ϊ�״��Ȼ���ԭ�ϣ������ڻ�������ЧӦ
ת��Ϊ�״��Ȼ���ԭ�ϣ������ڻ�������ЧӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʹ������к͵ζ����ⶨ���۰״���������g/100mL����
��ʵ�鲽�裺
��1������100mL����״���Һ����ȡ10.00mLʳ�ð״ף�ע���ձ�����ˮϡ�ͺ�ת�Ƶ������������ƣ��ж��ݣ�ҡ�ȼ��ã�
��2��ȡ����״���Һ20.00mL����ƿ�У������еμ�2����ָʾ����
��3����ȡʢװ0.1000mol/L NaOH ��Һ�������������ƣ��ij�ʼ������
���Һ��λ������ͼ��ʾ�����ʱ�Ķ���ΪmL��![]()
��4���ζ�����ʱ��ֹͣ�ζ���
����¼NaOH��Һ���ն������ظ��ζ�3�Σ�
��5����ʵ���¼
����� | 1 | 2 | 3 | 4 |
V����Ʒ�� | 20.00 | 20.00 | 20.00 | 20.00 |
V��NaOH�������ģ� | 15.95 | 15.00 | 15.05 | 14.95 |
�����ݴ��������ۣ�
�����㣬���۰״�������=g/100mL��
��6���ڱ�ʵ��ĵζ������У����в�����ʹʵ����ƫ���������д��ţ�
a����ʽ�ζ����ڵζ�ʱδ�ñ�NaOH��Һ��ϴ
b����ʽ�ζ����ڼ����ڵζ�ǰ�����ݣ��ζ���������ʧ
c����ƿ�м������״���Һ���ټ�����ˮ
d����ƿ�ڵζ�ʱ����ҡ����������Һ�彦����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D����ѧ��ѧ�г��������ֲ�ͬ��������֮�������ͼ��ʾ��ת����ϵ��

��1�����A��B��C��D����10����������д��A�Ļ�ѧʽ��___________��D�Ļ�ѧʽ__________��
��2�����A��C��18���ӵ���,B��D��10���ӵ���,��д��A��B����Һ�з�Ӧ�����ӷ���ʽ:______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ��Fe(OH)2�����ڿ����м��ױ���������������ͼװ�ÿ����Ƶð�ɫ��Fe(OH)2�����������ڽϳ�ʱ���ڱ��ְ�ɫ��ʵ���п�ѡ�õ��Լ��У�NaOH��Һ����м��ϡH2SO4��

��Fe(OH)2�ڿ����б������Ļ�ѧ����ʽ��__________________��ʵ��������__________________��
�����Թܢ��������Լ���__________�����Թܢ��������Լ���__________��
�����Թܢ�͢��м����Լ����ʵ�����������___________(ѡ�����)��
�ټ���A���ų�����Ĵ���
�ڼн�ֹˮ��
�۴�ֹˮ��
���������ɵ�Fe(OH)2�����ܽϳ�ʱ�䱣�ְ�ɫ����������________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѪҺ�������Ҫ�����ƽ�⣺![]() ��ʹ����ѪҺpH������7.35��7.45������ͻᷢ�����ж�����ж�����pH��
��ʹ����ѪҺpH������7.35��7.45������ͻᷢ�����ж�����ж�����pH��![]() �仯��ϵ���±���
�仯��ϵ���±���
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
����˵������ȷ����
A. ��������ѪҺ�У� ![]() ��ˮ��̶ȴ��ڵ���̶�
��ˮ��̶ȴ��ڵ���̶�
B. ����ѪҺ���ж�ʱ����ע��![]() ��Һ����
��Һ����
C. ![]() ��ѪҺ�У�
��ѪҺ�У� ![]()
D. pH=7.40��ѪҺ�У� ![]() ��ˮ��̶�һ������
��ˮ��̶�һ������![]() �ĵ���̶�
�ĵ���̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ڼ��������������ˮ��Ӧ���ɼ�������ᷴӦ�����κ�ˮ���ǣ� ��
A.Na2OB.CO2C.NaOHD.CuO
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com