
【题目】C1O2是一种新型的环保饮用水消毒剂,某课题小组拟选择下列部分装置制备并收集二氧化氯来探究其漂白性(装置不可重复使用)。
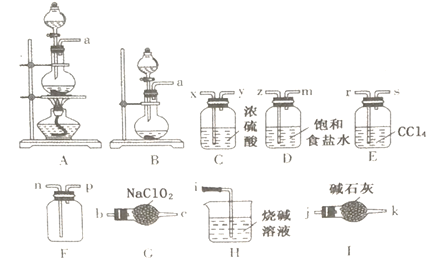
己知:常温下,亚氯酸钠(NaC1O2)可吸收氯气并制备二氧化氯;C1O2是一种易溶于水而难溶于有机溶剂的气体,氧化性比氯气强。
回答下列问题:
(1)制备干燥、纯净的氯气:制备的发生装置是_________ (填代号),//写出反应的离子方程式:__________。
(2)制备二氧化氯:导管口连接顺序为:a→______→n→p→j。本实验选择I而不选择H的原因是:_________________。
(3)写出G中发生反应的化学方程式:___________。
(4)装置E的作用是_____________________________。
(5)他们己收集一瓶二氧化氯气体,请你设计简易实验证明二氧化氯具有永久的漂白性:_________________________________________________________________________________________。
(6)尾气中的二氧化氯还可以用含双氧水的烧碱溶液吸收,其产物之一是NaC1O2。写出该反应的化学方程式:_____________________________。
【答案】 A(或B) MnO2+4H++2C1-![]() Mn2++Cl2↑+2H2O(或2MnO4-+16H++10C1-=2Mn2++5Cl2↑+8H2O z→m→x→y→b→c→r→s H中水会进入F中(倒吸进入或水蒸气进入) Cl2+2NaClO2=2ClO2+2NaCl 吸收二氧化氯中的氯气 取少量品红溶液于试管中,通入二氧化氯,观察到品红溶液褪色,再加热已褪色的溶液,溶液不变红色 2ClO2+2NaOH+H2O2=2NaClO2+O2+2H2O
Mn2++Cl2↑+2H2O(或2MnO4-+16H++10C1-=2Mn2++5Cl2↑+8H2O z→m→x→y→b→c→r→s H中水会进入F中(倒吸进入或水蒸气进入) Cl2+2NaClO2=2ClO2+2NaCl 吸收二氧化氯中的氯气 取少量品红溶液于试管中,通入二氧化氯,观察到品红溶液褪色,再加热已褪色的溶液,溶液不变红色 2ClO2+2NaOH+H2O2=2NaClO2+O2+2H2O
【解析】(1)制备干燥、纯净的氯气:常用固体+液体,加热或不加热,两种装置,制备的发生装置是A(或B) ,反应的离子方程式:MnO2+4H++2C1-![]() Mn2++Cl2↑+2H2O(或2MnO4-+16H++10C1-=2Mn2++5Cl2↑+8H2O 。(2)制备二氧化氯:A或B制备氯气,再通过D除去氯气中的氯化氢气体,然后,通过C中浓硫酸进行干燥,经过G中亚氯酸钠(NaC1O2)可吸收氯气并制备二氧化氯;再由E中四氯化碳除去末反应的氯气,用F收集,I用于吸收尾气,并防止空气中的水蒸气进入,管口连接顺序为:a→ z→m→x→y→b→c→r→s→n→p→j。本实验选择I而不选择H的原因是:H中水会进入F中(倒吸进入或水蒸气进入) 。(3)G中制备ClO2的反应的化学方程式:Cl2+2NaClO2=2ClO2+2NaCl。(4)装置E的作用是吸收二氧化氯中的氯气。(5)设计简易实验证明二氧化氯具有永久的漂白性:取少量品红溶液于试管中,通入二氧化氯,观察到品红溶液褪色,再加热已褪色的溶液,溶液不变红色。(6)尾气中的二氧化氯还可以用含双氧水的烧碱溶液吸收,其产物之一是NaC1O2。该反应的化学方程式:2ClO2+2NaOH+H2O2=2NaClO2+O2+2H2O。
Mn2++Cl2↑+2H2O(或2MnO4-+16H++10C1-=2Mn2++5Cl2↑+8H2O 。(2)制备二氧化氯:A或B制备氯气,再通过D除去氯气中的氯化氢气体,然后,通过C中浓硫酸进行干燥,经过G中亚氯酸钠(NaC1O2)可吸收氯气并制备二氧化氯;再由E中四氯化碳除去末反应的氯气,用F收集,I用于吸收尾气,并防止空气中的水蒸气进入,管口连接顺序为:a→ z→m→x→y→b→c→r→s→n→p→j。本实验选择I而不选择H的原因是:H中水会进入F中(倒吸进入或水蒸气进入) 。(3)G中制备ClO2的反应的化学方程式:Cl2+2NaClO2=2ClO2+2NaCl。(4)装置E的作用是吸收二氧化氯中的氯气。(5)设计简易实验证明二氧化氯具有永久的漂白性:取少量品红溶液于试管中,通入二氧化氯,观察到品红溶液褪色,再加热已褪色的溶液,溶液不变红色。(6)尾气中的二氧化氯还可以用含双氧水的烧碱溶液吸收,其产物之一是NaC1O2。该反应的化学方程式:2ClO2+2NaOH+H2O2=2NaClO2+O2+2H2O。


科目:高中化学 来源: 题型:
【题目】在下列变化①工业制盐酸 ②工业制漂粉精 ③实验室制氯气中,按氯元素被氧化、被还原、既被氧化又被还原的顺序排列,正确的是( )
A. ①②③ B. ②①③ C. ①③② D. ③①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A. 13C和14C属于同一种元素,它们互为同位素
B. 1H和2H是不同的核素,它们的质子数相等
C. 14C和14N的质量数相等,它们的中子数不等
D. 6Li和7Li的电子数相等,中子数也相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某纯碱样品中含有杂质氯化钠,为测定样品中纯碱的质量分数,可用如图装置进行实验。
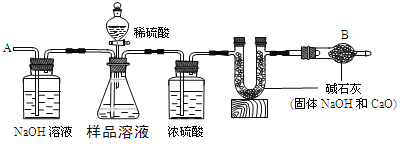
主要步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g样品放入锥形瓶中,加适量蒸馏水溶解,得到样品溶液
③称量盛有碱石灰的U型管的质量为b g
④由分液漏斗滴入5%的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量空气
⑥再次称量盛有碱石灰的U型管的质量为c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,称量其质量为d g
请回答下列问题:
(1)步骤③称量用的主要仪器是_________________________
(2)锥形瓶中发生反应的离子方程式为_____________________________
(3)装置中干燥管B的作用是_____________________________
(4)如果将分液漏斗中的硫酸换成相同浓度的盐酸,测试的结果_______(填偏高、偏低或不变)
(5)步骤⑤的目的是_______________________
(6)步骤⑦的目的是_______________________
(7)该样品中纯碱的质量分数的计算式为_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl-浓度与50 mL 1 mol·L-1AlCl3溶液中Cl-的物质的量浓度不相等的是
A. 50 mL 3 mol·L-1 NH4Cl溶液
B. 150 mL 1 mol·L-1的NaCl溶液
C. 50 mL 3 mol·L-1的KCl溶液
D. 100 mL 1 mol·L-1的FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是气体性质实验的常用装置,下列对有关实验现象的说法中不正确的是( )
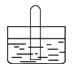
A.若水槽中是NaOH溶液,试管中是Cl2,可看到液面上升,试管中黄绿色褪去
B.若水槽中是水(并滴有酚酞),试管中是NH3,可看到液面上升并呈红色
C.若水槽中是水,试管中是NO2,可看到试管中液面上升并充满整个试管
D.若水槽中和试管中都是氯水,光照后可在试管中收集到氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJmol﹣1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=﹣1452kJmol﹣1
H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJmol﹣1
下列说法正确的是( )
A.H2(g)的燃烧热为571.6 kJ?mol﹣1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.![]() ?H2SO4(aq)+
?H2SO4(aq)+ ![]() ?Ba(OH)2(aq)=
?Ba(OH)2(aq)= ![]() ?BaSO4(s)+H2O(l)△H=﹣57.3 kJ?mol﹣1
?BaSO4(s)+H2O(l)△H=﹣57.3 kJ?mol﹣1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l)△H=+135.9 kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三套实验装置,分别回答下列问题. 
(1)装置1为铁的吸氧腐蚀实验.一段时间后,向插入石墨棒的玻璃筒内滴入酚酞溶液,可观
察到石墨棒附近的溶液变红,则该装置中石墨电极的反应式为 .
(2)装置2中的铜是极(填“正”或“负”),该装置中石墨电极所发生的反应为 .
(3)装置3中甲烧杯盛放100mL 0.2molL﹣1的NaCl溶液,乙烧杯盛放100mL 0.5molL﹣1
的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附
近首先变红.
①烧杯中铁为极;甲烧杯中石墨电极的电极反应式为 .
②乙烧杯中电解反应的离子方程式为 .
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64g,甲烧杯中产生的气体在标准状况下的体积为mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( ) 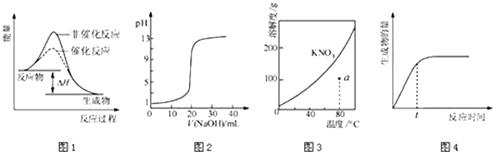
A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示0.1000molL﹣1NaOH溶液滴定20.00mL0.1000molL﹣1CH3COOH溶液所得到的滴定曲线
C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
D.图4 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com