
【题目】如图所示三套实验装置,分别回答下列问题. 
(1)装置1为铁的吸氧腐蚀实验.一段时间后,向插入石墨棒的玻璃筒内滴入酚酞溶液,可观
察到石墨棒附近的溶液变红,则该装置中石墨电极的反应式为 .
(2)装置2中的铜是极(填“正”或“负”),该装置中石墨电极所发生的反应为 .
(3)装置3中甲烧杯盛放100mL 0.2molL﹣1的NaCl溶液,乙烧杯盛放100mL 0.5molL﹣1
的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附
近首先变红.
①烧杯中铁为极;甲烧杯中石墨电极的电极反应式为 .
②乙烧杯中电解反应的离子方程式为 .
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64g,甲烧杯中产生的气体在标准状况下的体积为mL.
【答案】
(1)O2+4e﹣+2H2O﹣═4OH﹣
(2)负;Fe3++e﹣=Fe2+
(3)阳;2H++2e﹣═H2;2Cu2++2H2O ![]() 2Cu+O2↑+4H+;224
2Cu+O2↑+4H+;224
【解析】解:(1.)铁发生吸氧腐蚀,正极发生还原反应,氧气得到电子被还原生成OH﹣ , 电极方程式为O2+4e﹣+2H2O﹣═4OH﹣ , 所以答案是:O2+4e﹣+2H2O﹣═4OH﹣;
(2.)铜可被Fe3++氧化,发生Cu+2Fe3+=Cu2++2Fe2+ , 形成原电池反应时,铜为负极,发生氧化反应,石墨为正极,正极反应为Fe3++e﹣=Fe2+ , 所以答案是:负; Fe3++e﹣=Fe2+;
(3.)乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,①向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明石墨极生成4OH﹣ , 应为电解池的阴极,则M为正极,N为负极,铁为阳极,电解氯化钠溶液,阴极发生还原反应生成氢气,电极方程式为2H++2e﹣═H2 , 所以答案是:阳; 2H2O+2e ﹣=H2↑+2OH﹣或2H++2e﹣═H2;
②乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,电解方程式为2Cu2++2H2O ![]() 2Cu+O2↑+4H+ , 所以答案是:2Cu2++2H2O
2Cu+O2↑+4H+ , 所以答案是:2Cu2++2H2O ![]() 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为 ![]() =0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
=0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
甲烧杯中,阳极铁被氧化,阴极产生气体为氢气,
2H2O | + | 2e﹣ | ═ | 2OH﹣ | + | H2↑ |
2mol | 22.4L | |||||
0.02mol | V |
V= ![]() =0.224L,即224mL,所以答案是:224.
=0.224L,即224mL,所以答案是:224.


科目:高中化学 来源: 题型:
【题目】关于氧化还原反应,下列说法正确的是( )
A.失去电子,化合价降低的物质是还原剂B.被氧化的物质是还原剂
C.氧化剂被氧化,还原剂被还原D.氧化剂失去电子,化合价升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C1O2是一种新型的环保饮用水消毒剂,某课题小组拟选择下列部分装置制备并收集二氧化氯来探究其漂白性(装置不可重复使用)。
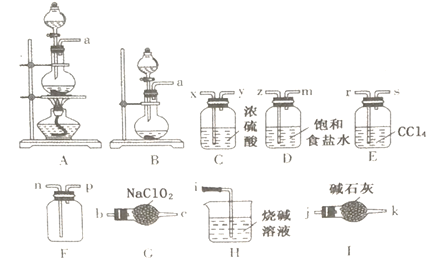
己知:常温下,亚氯酸钠(NaC1O2)可吸收氯气并制备二氧化氯;C1O2是一种易溶于水而难溶于有机溶剂的气体,氧化性比氯气强。
回答下列问题:
(1)制备干燥、纯净的氯气:制备的发生装置是_________ (填代号),//写出反应的离子方程式:__________。
(2)制备二氧化氯:导管口连接顺序为:a→______→n→p→j。本实验选择I而不选择H的原因是:_________________。
(3)写出G中发生反应的化学方程式:___________。
(4)装置E的作用是_____________________________。
(5)他们己收集一瓶二氧化氯气体,请你设计简易实验证明二氧化氯具有永久的漂白性:_________________________________________________________________________________________。
(6)尾气中的二氧化氯还可以用含双氧水的烧碱溶液吸收,其产物之一是NaC1O2。写出该反应的化学方程式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量干燥的氨气涉及下列装置,其中正确的是
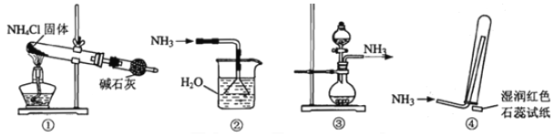
A. ①是氨气发生装置 B. ②是氨气吸收装置
C. ③是氨气发生装置 D. ④是氨气收集、检验装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象与胶体的性质无关的是
A. 将盐卤或石膏加入豆浆,制成豆腐
B. 一枝钢笔使用两种不同型号的蓝黑墨水,易出现堵塞
C. 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀
D. 清晨,人们经常看到阳光穿过茂密的树木枝叶所产生的美丽“光柱”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中的珊瑚虫经如下反应形成石灰石外壳,进而形成珊瑚:![]() 。与珊瑚虫共生的藻类会消耗海洋中的
。与珊瑚虫共生的藻类会消耗海洋中的![]() 。气候变暖、温室效应的加剧干扰了珊瑚虫的生长,甚至致其死亡。下列说法不合理的是
。气候变暖、温室效应的加剧干扰了珊瑚虫的生长,甚至致其死亡。下列说法不合理的是
A. 共生藻类消耗![]() ,有利于珊瑚的形成
,有利于珊瑚的形成
B. 海洋中![]() 浓度升高,抑制了珊瑚的形成
浓度升高,抑制了珊瑚的形成
C. 温度升高会增大![]() 在海水中的溶解度,抑制了珊瑚的形成
在海水中的溶解度,抑制了珊瑚的形成
D. 将![]() 转化为甲醇等化工原料,有助于缓解温室效应
转化为甲醇等化工原料,有助于缓解温室效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到(填仪器名称)中定容,摇匀即得.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴作指示剂.
(3)读取盛装0.1000mol/L NaOH 溶液的(填仪器名称)的初始读数.
如果液面位置如右图所示,则此时的读数为mL.![]()
(4)滴定.当时,停止滴定,
并记录NaOH溶液的终读数.重复滴定3次.
(5)Ⅱ.实验记录
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
经计算,市售白醋总酸量=g/100mL.
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管在尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时距离摇动,有少量液体溅出.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白色的Fe(OH)2沉淀在空气中极易被氧化。利用如右图装置可以制得白色的Fe(OH)2沉淀,并能在较长时间内保持白色。实验中可选用的试剂有:NaOH溶液、铁屑、稀H2SO4。

⑴Fe(OH)2在空气中被氧化的化学方程式是__________________,实验现象是__________________。
⑵在试管Ⅰ里加入的试剂是__________;在试管Ⅱ里加入的试剂是__________。
⑶在试管Ⅰ和Ⅱ中加入试剂后的实验操作依次是___________(选填序号)。
①检验A口排出气体的纯度
②夹紧止水夹
③打开止水夹
⑷这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com