
【题目】常见物质A~K之间存在如下图所示的转化关系,其中D、E为单质,请回答下列问题(图中有些反应的产物和反应的条件没有全部标出)。
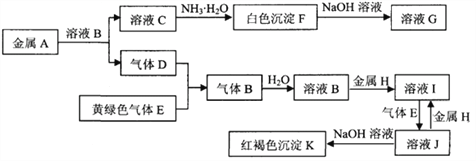
(1)写出下列物质中溶质的名称:B是 __________,G是____________
(2)反应“F→G”的化学方程式是_____________________________________________
(3)反应“J→I”的离子方程式是_____________________________________________
(4)溶液I中混有溶液J,除去J的方法是:___________________________
(5)检验溶液I中阳离子的方法是:__________________________
(6)向30 mL 1 mol·L-1的C溶液中逐渐加入浓度为4 mol·L-1的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为______________mL。
【答案】 氯化氢 偏铝酸钠 Al(OH)3+NaOH=NaAlO2+2H2O 2Fe3++Fe=3Fe2+ 加入足量的铁粉(过滤) 取少量溶液I于试管中,滴加几滴硫氰化钾溶液,溶液不变红色,再加几滴氯水,溶液变为红色,证明溶液中含有Fe2+。(其它方法,正确也给分) 7.5 和27.5
【解析】本题考查无机推断,黄绿色气体为Cl2,根据氯气的化学性质,即气体D为H2,气体B为HCl,红褐色沉淀K为Fe(OH)3,即金属H为Fe,溶液I为FeCl2,溶液J为FeCl3,溶液C加入NH3·H2O出现白色沉淀,白色沉淀F中加入NaOH溶液,沉淀溶解,因此白色沉淀F为Al(OH)3,即金属A为Al,(1)根据上述分析,气体B为氯化氢,F为偏铝酸钠;(2)F→G化学反应方程式为Al(OH)3+OH-=AlO2-+2H2O;(3)J→I的离子反应方程式2Fe3++Fe=3Fe2+;(4)除去混在Fe2+中的Fe3+,向溶液I中加入铁粉,然后过滤;(5)检验Fe2+的方法:取少量溶液I,滴加几滴KSCN溶液,溶液不变红,再加入氯气或H2O2,溶液变为红色,证明溶液中含有Fe2+;(7)C溶液为AlCl3,当加入NaOH溶液,只发生Al3++3OH-=Al(OH)3↓, 消耗NaOH的体积![]() L=0.0075L,合7.5mL,如果发生Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,当AlCl3全部生成氢氧化铝沉淀,此时氢氧化铝的物质的量为30×10-3×1mol=0.03mol,此时氢氧化钠的物质的量为0.09mol,因为产生沉淀0.78g,说明有一部分氢氧化铝与NaOH发生反应,此时消耗NaOH的物质的量为(0.03-0.01)mol=0.02mol,因此氢氧化钠的体积=(0.09+0.02)/4L=0.0275L,合27.5mL。
L=0.0075L,合7.5mL,如果发生Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,当AlCl3全部生成氢氧化铝沉淀,此时氢氧化铝的物质的量为30×10-3×1mol=0.03mol,此时氢氧化钠的物质的量为0.09mol,因为产生沉淀0.78g,说明有一部分氢氧化铝与NaOH发生反应,此时消耗NaOH的物质的量为(0.03-0.01)mol=0.02mol,因此氢氧化钠的体积=(0.09+0.02)/4L=0.0275L,合27.5mL。


科目:高中化学 来源: 题型:
【题目】硫化钠广泛应用于染料工业。请完成下列各题:
(1)![]() 的核外电子排布式_______________,其核外有_______种不同运动状态的电子。写出Na2O的电子式___________,比较Na2O和Na2S的熔点高低:Na2O______Na2S。
的核外电子排布式_______________,其核外有_______种不同运动状态的电子。写出Na2O的电子式___________,比较Na2O和Na2S的熔点高低:Na2O______Na2S。
(2)O、S属于同主族元素,其单质的氧化性不同,用一反应的化学方程式表示:_____________,O、S、![]() 半径从大到小的顺序是_________________。
半径从大到小的顺序是_________________。
II.1100℃时,在体积固定且为5L的密闭容器中,发生可逆反应: ![]() 并达到平衡。
并达到平衡。
(1)上述平衡的平衡常数表达式![]() _____________。欲使
_____________。欲使![]() 值变大,可采取的措施是__________________________。平衡后,向容器中充入1mol H2,平衡向__________(填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,逆反应速率______(填“增大”、“减小”或“不变”)。
值变大,可采取的措施是__________________________。平衡后,向容器中充入1mol H2,平衡向__________(填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,逆反应速率______(填“增大”、“减小”或“不变”)。
(2)若混合气体的密度不变,(填“能”或“不能”)_________判断该反应已经达到平衡状态。若初始时加入的Na2SO4为2.84g,10分钟后达到平衡时Na2SO4的转化率为45%, ![]() ________。
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中,若忽略水的电离,只含有下表中所示的四种离子,推测X离子及其个数b可能为
离子 | Na+ | Al3+ | Cl- | X |
个数 | 3a | 2a | a | b |
A.OH-、8aB.NO3-、4aC.SO42-、4aD.SO42-、8a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用化学方程式解释现行高中化学教材中的下列事实:
(1)用FeCl3溶液制作印刷电路板:_________________________________
(2)工业制漂白粉:______________________________________________
(3)由石英砂制粗硅:_____________________________________________
(4)玻璃刻花的反应原理:_____________________________________________
(5)盛放NaOH溶液的试剂瓶不能用玻璃塞:_______________________________
(6)氢氧化钠溶液腐蚀金属铝:_____________________________________________
(7)单质硅与氢氧化钠溶液的反应:__________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO(g)+Br2(g)![]() 2NOBr(g)(正反应放热)。下列说法正确的是
2NOBr(g)(正反应放热)。下列说法正确的是
容器 编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(NO) | c(Br2) | c(NOBr) | c(NOBr) | |
I | 0.3 | 0.15 | 0.1 | 0.2 |
II | 0.4 | 0.2 | 0 | |
III | 0 | 0 | 0.2 | |
A. 容器II达平衡所需的时间为4min,则v(Br2)=0.05mol/(Lmin)
B. 达平衡时,容器I与容器III中的总压强之比为2:1
C. 升高温度,逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
D. 达平衡时,容器II中c(Br2)/c(NOBr)比容器III中的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中肯定错误的是( )
A. 某原子K层上只有一个电子
B. 某原子M层上电子数为L层上电子数的4倍
C. 某离子M层上和L层上的电子数均为K层的4倍
D. 某离子的核电荷数与最外层电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下述正确的是
A. 64g二氧化硫SO2含有原子数为3NA
B. 1L 1mol/L的氯化钠溶液中,所含离子数为NA
C. 标准状况下,11.2L水所含分子数为0.5 NA
D. 在反应中,1mol镁转化为Mg2+后失去的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不是因为胶体的性质而产生的现象是( )
A.明矾净水时使水中悬浮颗粒沉淀B.清晨树林中的一道道光柱
C.江河入海口易形成三角洲D.澄清石灰水中通入CO2气体,有白色的沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向![]() 浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料得知:
浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料得知:![]() 。下列分析不正确的是
。下列分析不正确的是
A. 浊液中存在沉淀溶解平衡:![]()
B. 实验可以证明![]() 结合
结合![]() 能力比
能力比![]() 强
强
C. 实验表明实验室可用氨水洗涤银镜反应后的试管
D. 由资料信息可推知:加浓硝酸后生成的沉淀为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com